
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
【答案】
(1)分液漏斗;防止倒吸
(2)使Na2SO3完全反应,避免产生SO2
(3)控制硫酸滴入速度
(4)ClO3﹣
(5)2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑
(6)②;⑤⑥
(7)26.6
【解析】解:实验过程分析:装置A中盛放硫酸、NaClO3和Na2SO3 , 反应生成ClO2气体:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,ClO2气体和H2O2在B发生发生氧化还原反应:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2 , 发生反应可能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;(1)根据图示可知仪器a为分液漏斗;亚硫酸钠具有还原性,在反应中作还原剂;装置A中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,ClO2进入装置B,发生反应使装置内压强降低,可能发生倒吸,装置C的作用为防止倒吸;所以答案是:分液漏斗;防止倒吸;(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全,所以该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2 , 所以答案是:使Na2SO3完全反应,避免产生SO2;(3)缓慢通入ClO2 , 可以使ClO2气体被均匀、充分吸收,ClO2是硫酸、NaClO3与亚硫酸钠反应生成的,所以要使ClO2气体能被均匀、充分吸收,应该控制控制硫酸滴入速度;所以答案是:控制硫酸滴入速度;(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3﹣;所以答案是:ClO3﹣;(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2 , 二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,则H2O2中O元素化合价由﹣2价变为0价,产物为O2和H2O,反应的离子方程式为:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑,所以答案是:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑;(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入非氧化性酸酸化,再加入含Fe2+的化合物,若有Fe3+生成,则证明NaClO2具有氧化性,用KSCN溶液检验Fe3+ , 现象是溶液变红;所以答案是:②;⑤⑥;(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,所以答案是:②;⑤⑥;(7)28.9 g NaClO23H2O(式量:144.5),n(NaClO23H2O)= ![]() =
= ![]() =0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO23H2O)=0.2mol,m(NaClO3)=n(NaClO3)M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为:
=0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO23H2O)=0.2mol,m(NaClO3)=n(NaClO3)M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为: ![]() ≈26.6g,所以答案是:26.6.
≈26.6g,所以答案是:26.6.


科目:高中化学 来源: 题型:
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 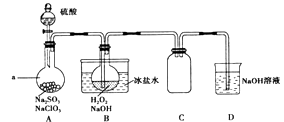
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断错误的是
A. 稳定性:H2O>NH3>CH4B. 原子半径:N<O<F
C. 酸性:HClO4>H2SO4>H3PO4D. 碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表格中的各种情况,可以用如图的曲线表示的是( )
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
D | 2molSO2和1molO2 , 在相同温度下 | SO3 的浓度 | 2个大气压 | 10个大气压 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜矿石含有CuO和难溶于水的Cu2(OH) 2CO3 , 还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: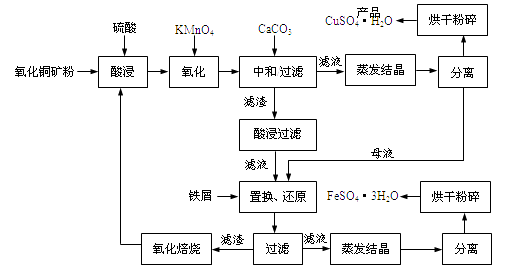
(1)氧化铜矿石粉碎的目的是,KMnO4的作用是将Fe2+氧化成Fe3+。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是,使Fe3+ 水解成沉淀而除去。
(4)流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。
(5)加入铁屑的作用是使母液中Fe3+转化为Fe2+、。
(6)下表为硫酸铜晶体“烘干粉碎”的试验结果。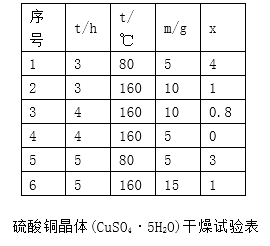
表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为(指出条件的温度和时间)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( ) 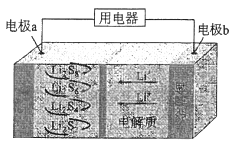
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的Li2S2量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之牢盆,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是
A. 加热 B. 结晶 C. 蒸发 D. 过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com