
分析 (1)两种或两种以上物质生成一种物质的反应为化合反应;
(2)一种单质与一种化合物反应生成另外一种单质与另外一种化合物的反应为置换反应;
(3)酸与碱反应生成盐和水,此类反应为酸碱中和反应;
(4)两种物质相互交换阴阳离子的反应为复分解反应,据此概念解答即可.
解答 解:(1)生石灰与水反应生成氢氧化钙为化合反应,化学反应方程式为:CaO+H2O=Ca(OH)2,故答案为:CaO+H2O=Ca(OH)2;
(2)铁的活泼性强于铜,能与硫酸铜溶液反应置换出Cu,化学反应方程式为:Fe+CuSO4=Cu+FeSO4,故答案为:Fe+CuSO4=Cu+FeSO4;
(3)烧碱与盐酸反应生成氯化钠和水,化学反应方程式为:NaOH+HCl═NaCl+H2O,故答案为:NaOH+HCl═NaCl+H2O;
(4)硝酸银和氯化钡反应生成氯化银沉淀,属于复分解反应,化学反应方程式为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,故答案为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2.
点评 本题主要考查的是四大基本反应类型的概念以及化学反应方程式的书写,难度不大,为常考题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. +Br2→
+Br2→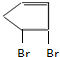 、
、 +Br2→
+Br2→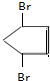 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
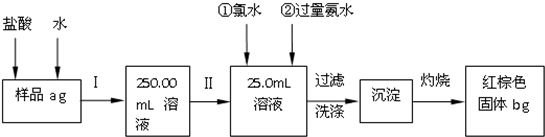
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| C | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1 | B. | l mol•L-1 | C. | 2 mol•L-1 | D. | 3 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com