
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:单选题
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2既作还原剂也作氧化剂,硫元素被氧化 |
| C.每生成1 molCu2S,有4mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.浓硫酸可干燥H2、SO2、NH3等气体 |
| B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生 |
| C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| D.足量的硫单质与64g铜反应,有2mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知NO2遇水发生反应:2NO2 + H2O → HNO2 + HNO3。实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2。下列说法错误的是
| A.HNO2非常不稳定,其分解产物为NO和H2O |
| B.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解 |
| C.HNO2的酸性弱于碳酸的酸性 |
| D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
由反应:①Tl3++2Ag→Tl++2Ag+;②Fe+Cu2+→Fe2++Cu;③2Ag++Cu→Cu2++2Ag 得出的结论正确的是
| A.氧化性:Ag+>Tl3+>Cu2+>Fe2+ | B.还原性: Fe>Cu>Ag>Tl |
| C.氧化性:Tl 3+>Ag+>Cu 2+>Fe 2+ | D.还原性: Tl +>Ag>Cu>Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1︰5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的应用不涉及氧化还原反应的是
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
| A.1∶1∶3 | B.1∶2∶4 | C.1∶1∶4 | D.1∶3∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下: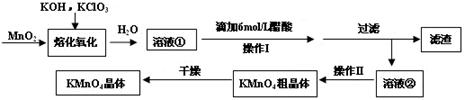
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com