

分析 根据除去粗盐中的泥沙、MgCl2、CaCl2、Na2SO4杂质,即除去镁离子、钙离子和硫酸根离子和泥沙,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,据此分析解答.
解答 解:(1)第②步操作加入过量的BaCl2主要是除去粗盐中的Na2SO4杂质即除去SO42-,离子方程式为:Ba2++SO42-═BaSO4↓;
故答案为:SO42-;Ba2++SO42-═BaSO4↓;
(2)根据流程,第②步操作加入过量的BaCl2主要是除去粗盐中的SO42-杂质,第③步操作加入过量的NaOH主要是除去粗盐中的Mg2+杂质,所以第④步应该加入过量的Na2CO3,除去钙离子和过量的钡离子,故答案为:Na2CO3;
(3)第③步操作加入过量的NaOH主要是除去粗盐中的Mg2+杂质,发生的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;故答案为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(4)第②步后溶液中剩下没有反应的氯化钡,第④步加入碳酸钠,生成碳酸钡、碳酸钙等,所以第⑤步“过滤”操作得到沉淀的成分有泥沙、BaSO4、Mg(OH)2、CaCO3除去以外,还有生成的BaCO3,故答案为:BaCO3;
(5)第 ⑦步操作为将NaCl溶液蒸发结晶、过滤得到精盐,故选:AB.
点评 本题主要考查了粗盐提纯过程中的除杂方面的知识,综合性强,双基要求高,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
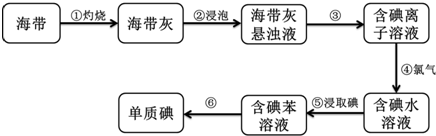
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0-50min之间,pH=2和pH=7时R的降解百分率不相等 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度和溶液的pH均影响R的降解速率 | |
| D. | 在 20-25min之间,pH=10 时R的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
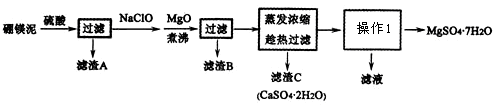
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com