

分析 除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,由步骤可知,粗盐溶于水后,用氯化钡除去硫酸根离子、用氢氧化钠除去镁离子、铁离子,用碳酸钠除去钙离子,由于加入的氯化钡试剂是过量的,则为了除去过量的钡离子,则碳酸钠应该放在氯化钡溶液之后,将沉淀过滤后用盐酸中和,再蒸发结晶至有大量晶体析出、少量液体剩余时停止加热即可,以此解答该题.
解答 解:(1)BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)A.称量时 NaCl 已潮解,则实际称量氯化钠质量偏小,配制溶液浓度偏低,故答案为:偏低;
B.天平的砝码已锈蚀,则实际称量固体质量偏大,配制浓度偏大,故答案为:偏大;
C.定容摇匀时,液面下降又加水,浓度偏低,故答案为:偏低;
D.定容时俯视刻度线,导致溶液体积偏小,浓度偏大,故答案为:偏大.
点评 本题考查混合物分离提纯实验设计,为高频考点,把握物质的性质、发生的反应、混合物分离为解答的关键,侧重分析与实验能力的综合考查,注意碳酸钠可除去过量的钡离子,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{N}{{N}_{A}}$表示该气体的物质的量 | |
| B. | $\frac{M}{{N}_{A}}$表示该气体一个分子的质量 | |
| C. | $\frac{\frac{m}{N}}{\frac{1}{12}m(C)}$表示该气体的相对分子质量 | |
| D. | $\frac{m}{N}$表示该气体所含原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
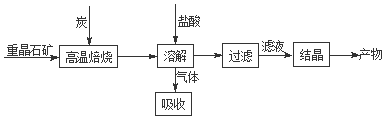
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
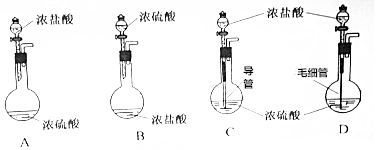
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>a>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
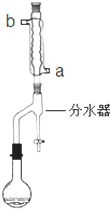 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
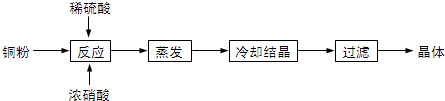
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF电离:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 水解消耗0.1mol F-时,吸收的热量为6.77kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1mol HF、0.1mol NaOH 的两种溶液混合后放出的热量为6.77kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com