
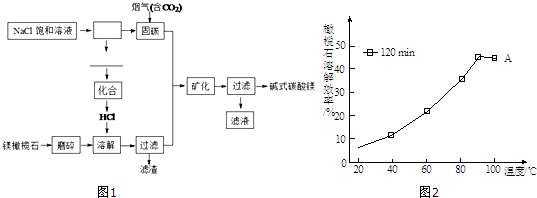
分析 设饱和一元醇的通式为CnH2n+1OH,与Na发生反应为:2CnH2n+1OH+2Na→2CnH2n+1ONa+H2↑,结合方程式计算计算出n,再根据碳酸确定该醇的分子式,最后根据该醇的性质确定其结构简式.
解答 解:设饱和一元醇的组成为CnH2n+1OH,则:
2CnH2n+1OH+2Na→2CnH2n+1ONa+H2↑,
2(14n+2+16)g 22.4L
2.3g 0.4292L
则:2(14n+2+16)g:2.3g=22.4L:0.4292L,
解得:n=3,
故该饱和一元醇为C3H7OH,其结构简式有:①CH3CH2CH2OH和②CH3CH(OH)CH3,
①CH3CH2CH2OH能够被催化氧化生成丙醛,②CH3CH(OH)CH3催化氧化生成丙酮,
所以该醇为CH3CH(OH)CH3,
故答案为:CH3CH(OH)CH3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握醇催化氧化产物与羟基位置的关系,试题侧重考查学生的分析、理解能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N具有相同的中子数 | B. | 13C与C60是同一种物质 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,晶体类型为分子晶体.
,晶体类型为分子晶体.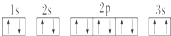 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)=0.001mol•L-1 | B. | 溶液中c(H+ )=10-11 mol•L-1 | ||
| C. | 由水电离出的c(H+ )=0.1mol•L-1 | D. | c(HCO3-)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 苯 | 溴 | 足量NaI溶液 | 分液 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ③④⑥ | C. | ②④⑤⑧ | D. | ①③④⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com