
���� ��1��������Ũ������ƽ�������ƶ���KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��2�������¶ȣ���Һ��ɻ�ɫ����֪�����¶�ƽ�������ƶ���
��3������Һ��Cl-ǡ����ȫ������Ũ��Ϊ1.0��10-5mol/L��ʱ��c��Ag+��=$\frac{2.0��1{0}^{-10}}{1.0��1{0}^{-5}}$=2.0��10-5mol/L�����Ag2CrO4��KspΪ2.0��10-12���㣮
��� �⣺��1��������Ũ������ƽ�������ƶ�����Cr2O72-��ƽ��ת���ʼ�С��K=$\frac{{c}^{2}��{H}^{+}��{c}^{2}��Cr{{O}_{4}}^{2-}��}{c��C{r}_{2}{{O}_{7}}^{2-}��}$��
�ʴ�Ϊ����С��K=$\frac{{c}^{2}��{H}^{+}��{c}^{2}��Cr{{O}_{4}}^{2-}��}{c��C{r}_{2}{{O}_{7}}^{2-}��}$��
��2�������¶ȣ���Һ��ɻ�ɫ����֪�����¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ�����H��0��
�ʴ�Ϊ������
��3������Һ��Cl-ǡ����ȫ������Ũ��Ϊ1.0��10-5mol/L��ʱ��c��Ag+��=$\frac{2.0��1{0}^{-10}}{1.0��1{0}^{-5}}$=2.0��10-5mol/L����ʱ��Һ��c��CrO42-��=$\frac{2.0��1{0}^{-12}}{��2.0��1{0}^{-5}��^{2}}$=5��10-3mol/L��
�ʴ�Ϊ��5��10-3��
���� ���⿼��ƽ�ⳣ������ѧƽ���ƶ���Ϊ��Ƶ���㣬����K�����塢ƽ���ƶ���Ksp�ļ���Ϊ���Ĺؼ������ط�������������Ŀ��飬ע��ƽ���ƶ�ԭ����Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
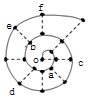 ͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų���ͼ��ʾ�ġ���ţ����״��ͼ��ÿ�������ϵġ�•������һ��Ԫ�أ�����O�������Ԫ�أ�����˵���д�����ǣ�������
ͬѧ���о�ǰ18��Ԫ��ʱ���֣����Խ������ų���ͼ��ʾ�ġ���ţ����״��ͼ��ÿ�������ϵġ�•������һ��Ԫ�أ�����O�������Ԫ�أ�����˵���д�����ǣ�������| A�� | ����������Ӧ��ˮ����ļ��ԣ�c��a | |
| B�� | �����Ӱ뾶��c��e��b | |
| C�� | ������Ӱ��ˮ�ĵ���������e��a��f | |
| D�� | ���ʵ��۵㣺c��d��e |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
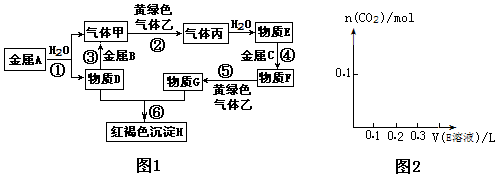
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����1��2 | B�� | ��1��2 | C�� | ����2��1 | D�� | ����2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 2H2O��g��=2H2��g��+O2��g����H=+483.6KJ/mol | |
| B�� | H2��ȼ����Ϊ241.8 KJ/mol | |
| C�� | Ũ����������������Һ��Ӧ����1molH2O��I�����ų�����Ҳ����57.3KJ | |
| D�� | ϡCH3COOH��Һ��ϡNaOH��Һ��Ӧ����1molH2O��l�����ų�����С��57.3KJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ��Һ�У�Na+��Cu2+��NO3-��Cl- | |
| B�� | ��pH=4����Һ�У�Na+��K+��OH-��Cl- | |
| C�� | �ں�Ba2+����Һ�У�H+��Na+��Cl-��SO42- | |
| D�� | ��Fe��Ӧ�����������Һ��Na+��K+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ӵĵ���ʽ��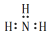 | B�� | Mg2+�ṹʾ��ͼ�� | ||
| C�� | ����Ľṹ��ʽ��CH3COOH | D�� | �Ҵ��ķ���ʽC2H5OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+����c��OH-�� | B�� | c��NH4+����c��Cl-�� | ||
| C�� | c��NH4+��+c��H+��=c��Cl-��+c��OH-�� | D�� | c��NH4+��+c��NH3��H2O��=0.10mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڱ�״���£�22.4Lˮ����������ĿΪNA | |
| B�� | 1mol•L-1 K2SO4��Һ����K+��ĿΪ2NA | |
| C�� | 1mol����������Ӧ����Na2O��Na2O2ʱ��ʧ������Ŀ��ΪNA | |
| D�� | O2��Ħ�����ԼΪ22.4 L•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com