
 一定条件下,向2L容积不变的密闭容器中加入一定量的N2、H2和NH3三种气体,发生反应:2NH3(g)?N2(g)+3H2(g)(△H>0),各物质的浓度随时间的变化如图1所示.图2为t2时刻后改变容器内的某一条件,反应速率(v)随时间(t)的变化情况.下列叙述正确的是( )
一定条件下,向2L容积不变的密闭容器中加入一定量的N2、H2和NH3三种气体,发生反应:2NH3(g)?N2(g)+3H2(g)(△H>0),各物质的浓度随时间的变化如图1所示.图2为t2时刻后改变容器内的某一条件,反应速率(v)随时间(t)的变化情况.下列叙述正确的是( )| A、若容器内气体的密度不再发生变化,则说明反应达到平衡状态 |
| B、若t1=20 s,则从t0~t1内的平均反应速率v(NH3)=0.01 mol?L-1?s-1 |
| C、图2中,t2时改变的条件是降低温度,t3时改变的条件是增大压强 |
| D、若t2时,再向容器中加入1.4 mol NH3、0.8 mol H2,则平衡将正向移动 |
| △c |
| V |
| 0.2mol/L |
| 20s |
| 0.63×0.5 |
| 0.82 |
| 1.4 |
| 2 |
| 0.8 |
| 2 |
| 13×0.5 |
| 1.52 |


科目:高中化学 来源: 题型:
| A、海水中含有镁元素,只需经过物理变化就可以得到镁单质 |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、从海水中可以得到MgCl2,电解MgCl2溶液可得到金属Mg |
| D、从海水中提取Br2、I2的过程中发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| A、25℃条件下,向该溶液中加入一定量的盐酸时,可使K=8×10-5 |
| B、25℃条件下,向该溶液中加入一定量的盐酸时,可使K=2×10-4 |
| C、标准状况下,醋酸溶液中K=1.75×10-5 |
| D、升高到一定温度,K=7.2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
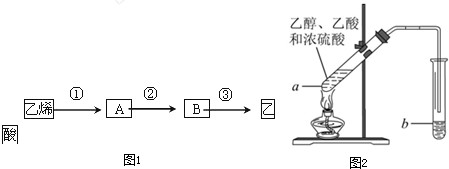
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、“地沟油”禁止食用,但可以用来制肥皂 |
| D、镀锡的钢铁器件既能增加美观.又可在镀层局部破损后防止器件的损耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl3溶液中加入镁粉有气泡产生 |
| B、NO2溶于水得到HNO3,所以NO2属于酸性氧化物 |
| C、C12、SO2均能使品红溶液褪色,说明二者均有漂白性 |
| D、向饱和NaC1溶液中先通入足量CO2,再通入足量NH3,可析出NaHCO3晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com