
| A. | 0.27 s | B. | 0.44 s | C. | 1.33 s | D. | 2 s |
分析 在N2+3H2?2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,根据方程式知,氢气浓度减少$\frac{3}{2}$×0.6mol/L=0.9mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(L•s),则所经历的时间=$\frac{△c}{v}$,据此分析解答.
解答 解:在N2+3H2?2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,根据方程式知,氢气浓度减少$\frac{3}{2}$×0.6mol/L=0.9mol/L,在此时间内用H2表示的平均反应速率为0.45mol/(L•s),则所经历的时间=$\frac{△c}{v}$=$\frac{0.9mol/L}{0.45mol/(L.s)}$=2s,故选D.
点评 本题考查化学反应速率有关计算,侧重考查学生分析计算能力,明确同一时间段内各物质浓度变化量与计量数关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
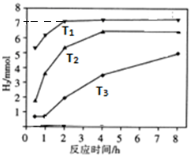 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.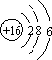 ;羰基硫分子的电子式为
;羰基硫分子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3与硫酸反应的实验中,实验室没有硫酸,临时用硝酸进行实验 | |
| B. | 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在加热下反应,并用排水集气法收集 | |
| D. | 配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,用水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的比例模型 | B. | 次氯酸的结构式为H-Cl-O | ||
| C. | CO2的电子式是: | D. | ${\;}_{8}^{18}$O2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com