
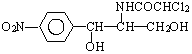
 .此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团
.此药物分子中碳链末端羟基(-OH)中的氢原子换成来自棕榈酸中的原子团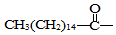 后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )
后,苦味消失,成为便于口服的无味氯霉素.以下关于无味氯霉素的叙述中正确的是( )| A. | 它是棕榈酸的盐类 | B. | 它不是棕榈酸的酯类 | ||
| C. | 它的水溶性变差,所以苦味消失 | D. | 它的水溶性变良,所以苦味消失 |
科目:高中化学 来源: 题型:选择题
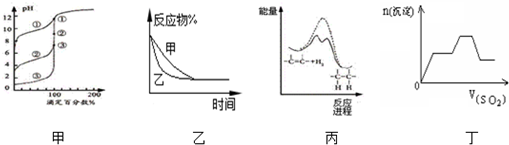
| A. | 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图甲曲线确定①的酸性最强 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 由图丙可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 | |
| D. | 图丁是足量的SO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入SO2的量的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
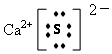 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,再移走酒精灯停止加热 | |
| B. | 蒸馏实验中,温度计的水银球应插入液态混合物中 | |
| C. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| D. | 蒸馏时,蒸馏时冷凝水从冷凝管下口进上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
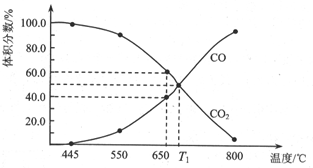 一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2与足量的C在恒容密闭容器中发生反应:C(s)+CO2(g)?2CO(g)△H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com