
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:___________________________。
(5)ZX的电子式为___________;ZX与水反应放出气体的化学方程式为____。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
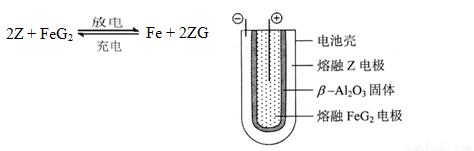
放电时,电池的正极反应式为_______________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
(1)第二周期第ⅥA族
(2)HClO4;H2S
(3)O3、Cl2
(4)2H2S(g)+3O2(g)=2SO2(g)+2H2O(l),△H=-2akJ?mol-1
(5)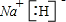 、NaH+H2O=NaOH+H2↑
、NaH+H2O=NaOH+H2↑
(6)Fe2++2e-=Fe;Na;β-Al2O3
【解析】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S;
(3)Y的单质O3、G的单质Cl2、二者形成的化合ClO2均可作消毒剂;
(4)H2S的燃烧热△H=-a kJ?mol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l),△H=-2akJ?mol-1,
(5)Na与水反应是氢氧化钠与氢气,反应化学方程式为NaH+H2O=NaOH+H2↑


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
将足量的SO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3-
B.H+、NH4+、Al3+、SO42-
C.Na+、Cl-、MnO4-、SO42-
D.Na+、CO32-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
物质的量浓度相同的下列溶液中,含离子和分子种类最多的是
A.CaCl2 B.CH3COONa
C.氨水 D.K2S
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu2+的浓度为
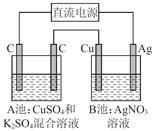
A.0.05 mol/L B.0.035 mol/LC.0.025 mol/L D.0.020 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
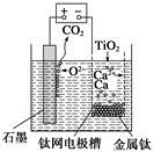
A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学甲烷、乙烯及其同系物、苯及其同系物(解析版) 题型:选择题
下列说法正确的是
A.丙烷是直链烃,所以分子中3个碳原子也在一条直线上
B.丙烯所有原子均在同一平面上
C.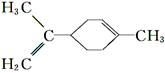 所有碳原子一定在同一平面上
所有碳原子一定在同一平面上
D.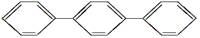 至少有16个原子共平面
至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为 。
②下列叙述不正确的是 。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含???6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在 。
A.共价键 B.非极性键 C.配位键D.σ键 E.π键
写出一种与 CN-互为等电子体的单质的分子式 。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于 区。
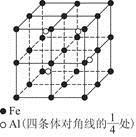
(4)一种Al—Fe合金的立体晶胞如图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度为ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:选择题
关于下列各实验装置的叙述中,不正确的是
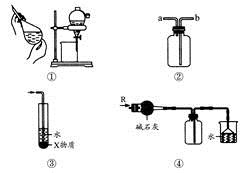
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com