
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 再滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 再滴加KSCN溶液,观察是否有血红色 |
分析 KI和FeCl3发生氧化还原反应,反应方程式为2KI+2FeCl3?2FeCl2+I2+2KCl,如果不是可逆反应,则溶液中不存在铁离子,如果存在可逆反应,则溶液中存在铁离子,只要证明含有铁离子即可,据此分析解答.
解答 解:KI和FeCl3发生氧化还原反应,反应方程式为2KI+2FeCl3?2FeCl2+I2+2KCl,如果不是可逆反应,则溶液中不存在铁离子,如果存在可逆反应,则溶液中存在铁离子,只要证明含有铁离子即可,实验室用KSCN溶液检验铁离子,所以其检验方法为再滴加KSCN溶液,观察是否有血红色,如果有血红色就说明为可逆反应,否则不是可逆反应,故选D.
点评 本题考查化学反应的可逆性,正确理解可逆反应是解本题关键,明确铁离子的检验方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 物质X、Y、Z有如图转化关系:请回答下列问题:
物质X、Y、Z有如图转化关系:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y分子式中氢原子数不一定要相同,碳原子数必定不同 | |
| B. | 若X为CH4,则相对分子质量最小的Y是甲醇 | |
| C. | 若X为CH4,则相对分子质量最小的Y是乙二醇 | |
| D. | X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2,3-二甲基戊烷.
2,3-二甲基戊烷.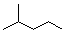 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.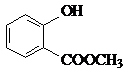 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应).
CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应). ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com