


| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.
某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.查看答案和解析>>
科目:高中化学 来源: 题型:
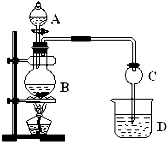 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管A | 试管B | |
| 加入试剂 | ||
| (预期)实验现象 (褪色时间) |
||
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com