
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。
【答案】(1)[Ar]3d64s2 或 1s22s22p63s23p63d64s2 ![]()
(2)N > O ; CS2 1:1
(3)MnO2+ 2Cl-+4H+△Cl2↑+Mn2+ +2H2O
(4)HF>HCl 因为元素非金属性F>Cl, 所以HF稳定;
HF>HCl 因为HF分子之间存在氢键,所以HF沸点高。
【解析】
试题分析:X原子最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则X含有两个电子层,最外层含有4个C,则X为C元素;Y的基态原子最外层电子排布为nsnnpn+1,s层含有2个电子,则n=2,Y的最外层电子排布式为:2s22p3,则Y为N元素;Z为非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰,则Z为S元素;基态原子的M层上有1个未成对的p电子,则M的电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为铝元素或氯元素,由于Z单质常温、常压下是气体,所以Z是Cl元素;Q与X形成的合金为目前用量最多的金属材料,该合金为钢,则Q为Fe元素,
综上所述:X、Y、Z、M、Q分别为C、N、S、Cl、Fe元素。
(1)Q为Fe元素,铁原子核外有26个电子,基态原子的电子排布式为:1s22s22p63s23p63d64s2,Y为氮元素,电子排布为:![]() 。(2)核外电子排布处于半充满、全充满、全空是稳定结构,N原子的2p能级是半充满状态,是稳定状态,因此第一电离能N>O;X和Z形成的化合物XZ2为CS2,结构为S=C=S,σ键和π键数目之比为1:1。(3)M为氯元素,其单质为氯气,实验室用二氧化锰与浓盐酸反应制取氯气,反应的离子方程式为:MnO2+ 2Cl-+4H+△Cl2↑+Mn2+ +2H2O 。(4)非金属性越强,对应气态氢化物越稳定,非金属性:F>Cl,则氢化物的稳定性HF>HCl;由于HF分子间存在氢键,所以氟化氢的沸点比HCl高,
。(2)核外电子排布处于半充满、全充满、全空是稳定结构,N原子的2p能级是半充满状态,是稳定状态,因此第一电离能N>O;X和Z形成的化合物XZ2为CS2,结构为S=C=S,σ键和π键数目之比为1:1。(3)M为氯元素,其单质为氯气,实验室用二氧化锰与浓盐酸反应制取氯气,反应的离子方程式为:MnO2+ 2Cl-+4H+△Cl2↑+Mn2+ +2H2O 。(4)非金属性越强,对应气态氢化物越稳定,非金属性:F>Cl,则氢化物的稳定性HF>HCl;由于HF分子间存在氢键,所以氟化氢的沸点比HCl高,


科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为____________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液
。 请写出A与稀、冷的KMnO4溶液
在碱性条件下反应生成物的结构简式__________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
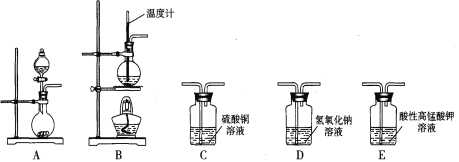
完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | __________________ | _________________________ |
(2) | 乙炔 | A→C→E | _________________________ |
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):

A的结构简式是__________________________________________________;
反应④的化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在元素周期表中的相对位置如下图所示。下列说法一定正确的是
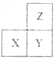
A. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
B. X、Y、Z的单质中,Z单质的熔点最高
C. 最高正化合价:Z>X
D. X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在科研及生产中均有着重要的应用。
(1)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)可逆反应PCl3(g)+Cl2(g)![]() PCl5(g) 2E(g)
PCl5(g) 2E(g)![]() F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
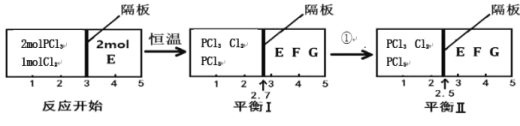
①达到平衡I时,体系压强与反应开始时体系压强之比为 。
②平衡I到平衡II的条件①是 (填“升温”或“降温”)。
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚磷酸,装置如图所示:

阴极的电极反应式为________________;产品室中反应的离子方程式为 。
(4)一定温度下,Ksp [Mg3(PO4)2] =6.0×10-29,Ksp [Ca3(PO4)2] =6.0×10-26。向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是
A. N a、Mg、Al原子的失电子能力逐渐减弱
B. Si、P、S元素的最高正化合价依次降低
C. C、N、O的原子半径依次减小
D. Cl、Br、I的气态氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖。右图是青蒿素的结构,则有关青蒿素的说法中不正确的是
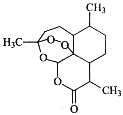
A.有“—O—”键,分子式C15H22O5,可发生取代反应
B.有“六元环”结构,是苯的同系物,可发生加成反应
C.有“—O—O—”键,氧化性较强,可发生还原反应
D.有“—COO—”键,碱性条件下,可发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com