
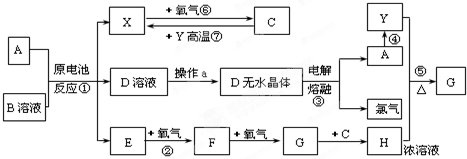
| ||
| ||
| ||
| △ |
| ||
| △ |
| ||
| ||
| ||
| ||
| ||
| ||


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、①④⑤ | B、②⑤⑥ |
| C、③⑤⑥ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
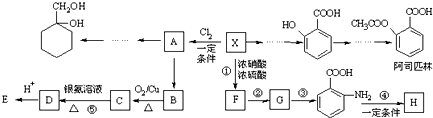
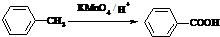
 (苯胺,易被氧化)
(苯胺,易被氧化)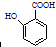 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 和其他无机物合成
和其他无机物合成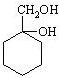 最合理的方案(不超过4步).
最合理的方案(不超过4步).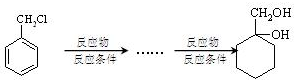
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定过程中,锥形瓶中有溶液溅出 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视 |
| B、滴定前锥形瓶内含有少量水 |
| C、滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D、碱式滴定管用蒸馏水洗净后,直接装入已知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
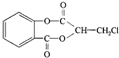 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).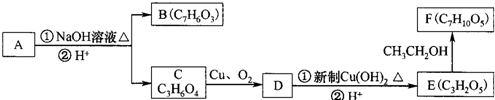
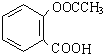 (即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH | 浓H2SO4 |
| 170℃ |
| H2 |
| 催化剂/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
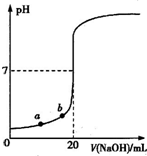
| A、水电离出的氢离子浓度:a>b |
| B、盐酸的物质的量浓度为0.0100mol?L-1 |
| C、指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D、当滴加NaOH溶液10.00mL时,该混合液的pH=1+lg3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
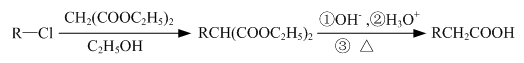
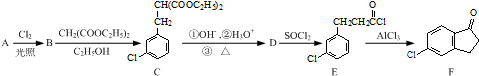
 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: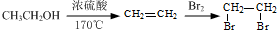
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com