
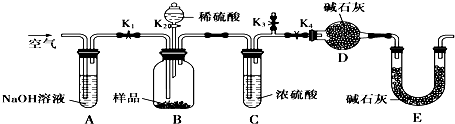
分析 (1)依据沉淀为氢氧化铜、碳酸铜或二者混合物假设判断,若生成碳酸铜说明是铜离子结合碳酸根离子,促进碳酸氢根离子电离;
(2)实验目的为测定沉淀中CuCO3的质量分数,由实验装置可知,A中NaOH溶液吸收二氧化碳,开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应,故应关闭K1、K3,打开K2、K4,反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低;而E装置可防止空气的二氧化碳、水进入装置D中,影响质量分数的测定,以此来解答.
解答 解:依据假设可知沉淀可逆是碳酸铜或氢氧化铜或二者混合物,假设2沉淀全部为Cu(OH)2,故答案为:沉淀全部是Cu(OH)2;
(1)若假设1正确,若生成碳酸铜说明是铜离子结合碳酸根离子,促进碳酸氢根离子电离,反应的离子方程式为Cu2++2HCO3-═CuCO3↓+H2O+CO2↑;
故答案为:Cu2++2HCO3-═CuCO3↓+H2O+CO2↑;
(2)①由实验目的及装置可知,开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,故正确的顺序是cab;
故答案为:cab;
②装置D的质量增加的2.2g为反应生成的二氧化碳的质量,二氧化碳的物质的量为=$\frac{2.2g}{44g/mol}$=0.05mol,根据碳元素守恒可知n(CuCO3)=n(CO2)=0.05mol,故碳酸铜的质量为0.05mol×124g/mol=6.2g,故沉淀中CuCO3的质量分数为$\frac{6.2g}{10g}$×100%=62%;
故答案为:62%;
③沉淀质量分数假设可知含有氢氧化铜沉淀,所以假设3正确,故答案为:3.
点评 本题考查物质含量的测定及性质实验方案设计,为高频考点,把握实验原理与装置的理解评价、对实验操作的理解、物质含量的测定、化学计算等为解答的关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与分析问题、解决问题能力,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与足量盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 铜与足量FeCl3溶液反应 Fe3++Cu═Fe2++Cu2+ | |
| C. | 钠与足量稀硫酸反应 2Na+2H+═2Na++H2↑ | |
| D. | 钠与足量MgCl2溶液反应 2Na+Mg2+═2Na++Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色透明溶液中大量存在:K+、Cu2+、SO42-、Na+ | |
| D. | 0.1 mol•L-1NaOH溶液大量存在:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 去年5月12日四川汶川发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
去年5月12日四川汶川发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2投入水中:2Na2O2+2H2O=4Na++4OH-+H2↑ | |
| B. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- | |
| C. | 钠投入CuSO4溶液中:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑ | |
| D. | 铜和稀HNO3反应:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →CH3-CHO+H2O
→CH3-CHO+H2O
 .
. .
. .
. (其中之一).
(其中之一).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| B. | 在硫酸亚铁溶液中,加入铁粉以防止氧化变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com