
| A. | CO、NO能与人体的血红蛋白结合,使人中毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 光化学烟雾会引起呼吸道疾病 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
分析 A.CO、NO能迅速与人体血红蛋白结合;
B.二氧化硫气体与氧化钙反应生成亚硫酸钙,进一步氧化为硫酸钙;
C.形成光化学烟雾的主要污染物是汽车尾气排放大量的氮氧化物;
D.CO2不能形成酸雨.
解答 解:A.CO、NO能迅速与人体血红蛋白结合,使人中毒,故A正确;
B.CaO能与SO2反应,可作工业废气的脱硫剂,二氧化硫气体与氧化钙反应生成亚硫酸钙,进一步氧化为硫酸钙;避免生成污染气体,故B正确;
C.光化学烟雾是汽车排放的尾气中的氮氧化物发生复杂的变化后形成的,氮氧化合物有毒,会引起呼吸道疾病,故C正确;
D.因酸雨的形成是由于SO2、NO2而引起的,与CO2无关,故D错误.
故选D.
点评 本题考查环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 113号元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
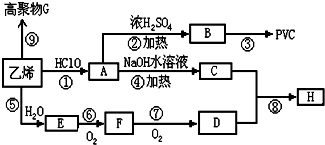
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
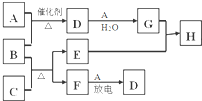 下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题:
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
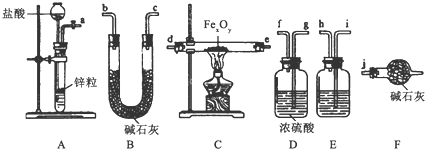
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 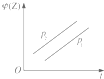 | B. |  | C. | 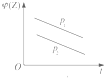 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com