
亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体:按下图装置进行制取。
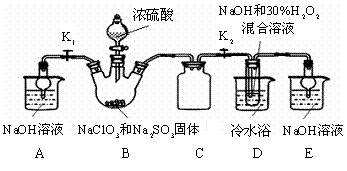 |
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶; ii.趁热过滤; iii. ; iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
NaClO2中含少量Na2SO4可用重结晶的方法提纯。下列有关物质的提纯方案不正确的
是
| 被提纯的物质 [括号内物质是杂质] | 除杂试剂 | 除杂方法 | |
| a | CO(g) [CO2(g)] | NaOH溶液、 浓H2SO4 | 洗气 |
| b | NH4Cl(aq) [Fe3+(aq)] | NaOH溶液 | 过滤 |
| c | Cl2(g) [HCl(g)] | 饱和食盐水、浓H2SO4 | 洗气 |
| d | Na2CO3(s) [NaHCO3(s)] | — | 加热 |
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
科目:高中化学 来源: 题型:
下列对实验操作或对实验事实的描述正确的是( )
A.用瓷坩埚熔化各种钠的化合物
B.向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象不同
C.配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏低
D.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在稀盐酸中,然后用蒸馏水稀释并加入少量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室干馏煤的装置图,回答下列问题:
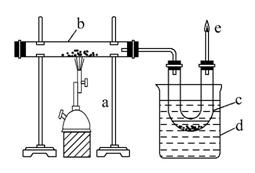
(1)指出图中仪器名称:
c ,d 。
(2)仪器d的作用是 ,
c中液体有 和 ,其中无机物里溶有 ,可用 检验出来。有机物可以通过 的方法使其中的重要成分分离出来。
(3)e处点燃的气体主要成分有 ,
火焰的颜色 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”。你知道其中的奥妙吗?请用化学方程式表示其反应原理:
__________________________________________________________________。
(2)铜在自然界多以+1价矿石存在,因为在固态或是高温下+1价铜比+2价铜稳定。辉铜矿(Cu2S)炼铜的方法之一是将矿石高温通空气焙烧,生成两种氧化物。将焙烧过的矿石加上比它质量约少一半的未经焙烧的矿石,混合后隔绝空气再进行高温熔烧,结果得到金属铜和一种具有刺激性气味的气体。这两个反应的化学方程式为 、 。
(3)已知CuS、Cu2S均为黑色不溶于水的固体,在空气中灼烧均生成CuO与SO2,不用其他试剂,设计最简单的实验来鉴别二者: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂。下列关于物质X的说法正确的是
A X分子式为C6H6O7
B 1 mol物质X可以和3 mol氢气发生加成
C X分子不可以发生消除反应
D 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组
是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:
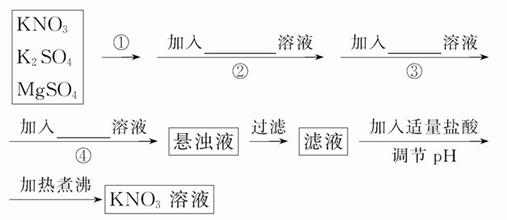
(1)操作①为 。
(2)操作②~④加入的试剂依次可以为:_________________________________。
(3)如何判断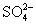 已除尽? ____________________________________________。
已除尽? ____________________________________________。
(4)实验过程中产生的多次沉淀__________(填“需要”或“不需要”)多次过滤,其理由是________________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由: _______________________
___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,反应SO2(g)+NO2(g)  SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
A.该温度下反应2SO2(g)+2NO2(g)  2SO3(g)+2NO(g)的平衡常数为0.48
2SO3(g)+2NO(g)的平衡常数为0.48
B.若该反应ΔH<0,则升高温度化学平衡常数K减小
C.若升高温度,逆反应速率减小
D. 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com