
| A. | 0.1 mol/L的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,C(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①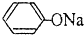 溶液②CH3COONa溶液中的c(Na+):①>② 溶液②CH3COONa溶液中的c(Na+):①>② |
分析 A.根据硫化钠溶液中的质子守恒判断;
B.氨水为弱碱,混合液中氨水过量,则c(OH-)>c(H+),结合电荷守恒判断;
C.氨水中氢氧根离子抑制了水的电离,醋酸钠溶液中醋酸根离子水解,促进了水的电离;
D.醋酸的酸性大于苯酚,则苯酚钠的水解程度大于醋酸钠,pH相同时醋酸钠的浓度较大.
解答 解:A.0.1 mol/L的Na2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B.pH=11的氨水与pH=3的硫酸各1L混合后,氨水为弱碱,混合液中氨水过量,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>2c(SO42-),故B正确;
C.pH=11的氨水与pH=11的醋酸钠溶液,前者氨水中氢氧根离子抑制了水的电离,后者醋酸根离子水解,促进了水的电离,则由水电离出的c(H+)前者小于后者,故C错误;
D.pH相同的① 溶液②CH3COONa溶液,苯酚钠的水解程度大于醋酸钠,则pH相同时苯酚钠的浓度小于醋酸钠,钠离子不水解,则溶液中的c(Na+):①<②,故D错误;
溶液②CH3COONa溶液,苯酚钠的水解程度大于醋酸钠,则pH相同时苯酚钠的浓度小于醋酸钠,钠离子不水解,则溶液中的c(Na+):①<②,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
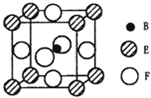 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
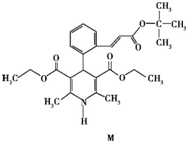
| A. | 属于芳香烃 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 1 mol M完全水解生成2 mol醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:O<S<Na | B. | 热稳定性:NH3<PH3<H2S | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻黄碱适应于医治因葡萄球菌和链球菌引起的血毒症 | |
| B. | 胃酸过多,出现反胃、吐酸等现象时,可服用小苏打 | |
| C. | 感冒发热头痛时,服用阿司匹林 | |
| D. | 因葡萄球菌等引起的发炎,注射青霉素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
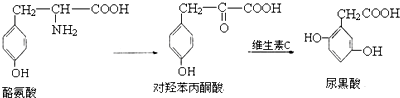
| A. | 1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 | |
| B. | 酪氨酸能发生加成、取代、消去和缩聚反应 | |
| C. | 1mol对羟苯丙酮酸最多可与5molH2反应 | |
| D. | 1mol尿黑酸最多可与3molBr2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 | 现 象 | 结 论 |
| A | T℃时,向NaCl和NaBr的混合溶液中滴加AgNO3溶液 | 先出现白色沉淀 | T℃时,Ksp: AgCl<AgBr |
| B | 向等浓度的Na2CO3溶液或Na2SO4溶液中滴加酚酞试剂 | Na2CO3溶液变红色Na2SO4溶液无明显现象 | 非金属性:S>C |
| C | 常温下,取饱和CaSO4溶液或氨水做导电性实验 | 氨水实验的灯泡较亮 | CaSO4和NH3•H2O均为弱电解质 |
| D | 向品红溶液中滴加NaClO溶液或通入SO2气体 | 品红溶液均褪为无色 | 两者均有漂白性且 原理相同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2加成反应:
,很多不饱和有机物在E催化下可与H2加成反应: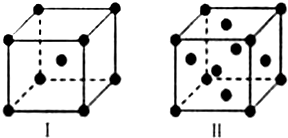
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com