
| A. | 盐酸、氨气和碳酸钠都是电解质 | |
| B. | 常温常压下,22.4L CO2气体的物质的量大于1mol | |
| C. | 2.4克石墨和C60的混合物所含碳原子数约为0.2×6.02×1023 | |
| D. | 氢氧化铁胶体较稳定,是因为该胶体带有正电荷 |
分析 A.盐酸属于混合物,氨气属于非电解质;
B.由PV=nRT可知,常温常压下,气体摩尔体积大于22.4L/mol;
C.石墨和C60的混合物只含有碳原子,根据n=$\frac{m}{M}$计算碳原子物质的量,再根据N=nNA计算碳原子数目;
D.氢氧化铁胶体胶粒带正电荷,氢氧化铁胶体不带电.
解答 解:A.盐酸属于混合物,既不是电解质也不是非电解质,氨气属于非电解质,故A错误;
B.由PV=nRT可知,常温常压下,气体摩尔体积大于22.4L/mol,常温常压下,22.4L CO2气体的物质的量小于1mol,故B错误;
C.石墨和C60的混合物只含有碳原子,含有碳原子物质的量为$\frac{2.4g}{12g/mol}$=0.2mol,所含碳原子数约为0.2×6.02×1023,故C正确;
D.氢氧化铁胶体胶粒带正电荷,氢氧化铁胶体不带电,故D错误,
故选C.
点评 本题考查电解质与非电解质、气体摩尔体积、物质的量有关计算、胶体,注意根据PV=nRT理解温度、压强对气体摩尔体积的影响,D选项为易错点,学生容易忽略胶体胶粒带电荷.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | n=m+1 | B. | n=m+10 | C. | n=m+11 | D. | n=m+25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Al3+含有的核外电子数为3×6.02×1023 | |
| B. | 将58.5 g NaCl溶于1.00 L水中,所得NaCl溶液的浓度为1.00 mol•L-1 | |
| C. | 2 mol SO2气体与足量的O2在一定条件下反应,转移的电子数为4×6.02×1023 | |
| D. | 常温下,100mL pH=1的硫酸溶液中含有的H+离子数为0.01×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2 中有4 NA个离子 | |
| B. | 常温常压下,11.2L氧气所含的原子数为NA | |
| C. | 1L 1mol/L CH3COONa溶液中含NA个CH3COO-离子 | |
| D. | 42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
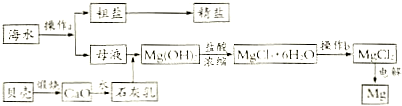
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC2H6O中含有C-C键的数目一定为NA | |
| B. | 25℃,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA | |
| C. | 标准状况下,2.24L异丁烷含有的分子数目为0.1NA | |
| D. | 常温常压下,0.3molNO2与足量H2O充分反应,转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 | |
| B. | KSP(AgCl)>KSP(Ag2CrO4),可说明Ag2CrO4比AgCl难溶于水 | |
| C. | 将0.00lmol•L-1AgNO3溶液滴入0.001 mol•L-1KC1和0.00lmol•L-1K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| D. | 同AgCl的悬浊液中滴加浓氨水后沉淀溶解,是因为生成了银氨离子而使AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
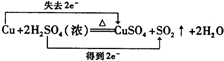 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com