
| A. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| B. | 75%的酒精可使蛋白质变性从而起到消毒作用 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
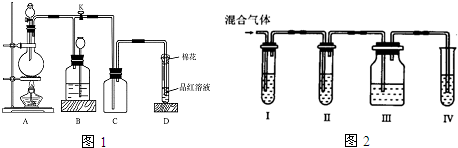
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
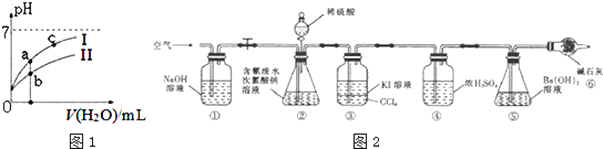
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
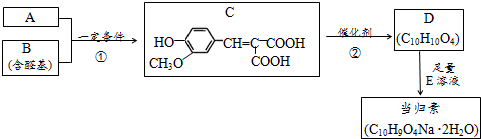
 ;
;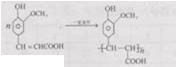 ;
;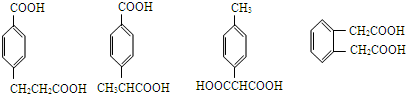 (其中两种).
(其中两种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯醛的结构简式:CH2═CHCHO | |
| B. | CSO的电子式: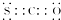 | |
| C. | 硫酸氢钠熔融时的电离方程式:NaHSO4═Na++HSO4- | |
| D. | S2-的结构示意图: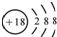 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
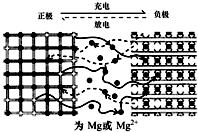 镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )
镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )| A. | 放电时,电池中的Mg2+从负极移向正极 | |
| B. | 其负极反应为:xMg-2xe-+Mo3S42x-═MgxMo3S4 | |
| C. | 充电时阳极反应式:MgxMo3S4-2xe-═Mo3S4+xMg2+ | |
| D. | 由于镁的密度较小,且Mg2+携带两个正电荷,这为高能量电池的设计提供了一个可靠依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热变成水蒸气 | |
| B. | 将蔗糖加入水中,得到蔗糖溶液 | |
| C. | 通过改变温度从空气中分离出氧气 | |
| D. | 向沸水中逐滴加入FeCl3饱和溶液,继续煮沸制备Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com