
写出下列反应的热化学方程式
(1)在25℃,101 Kpa 下1 mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为1366.8 kJ,试写出表示乙醇燃烧的热化学方程式:____
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。已知:N2(g)+2O2 (g)=2NO2(g) △H=+67.7kJ/mol
2N2H4(g)+2NO2 (g)=3N2(g)+4H2O(g)△H= 一1135.7kJ/ mol
则肼完全燃烧的热化学方程式为 。
(3)高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO(g)= Fe(s)+ CO2(g) △H>0。
①此反应的平衡常数表达式为 ;
②温度升高平衡常数K值 (填“增大”、“减小”、或“不变”)
③已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“不是” )处于化学平衡状态,此时化学反应速率是
)处于化学平衡状态,此时化学反应速率是
v正 v逆(填“<”、“>”或“=”)。
科目:高中化学 来源: 题型:
在2012年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的电子式是 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中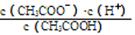 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
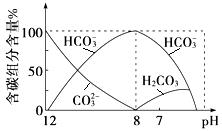
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在恒容密闭容器中发生如下反应:2X(g)+Y(g) 3Z(g),若反应开始时充入2mol X和2mol Y,达平衡后Y的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后Y的体积分数>a%的是
3Z(g),若反应开始时充入2mol X和2mol Y,达平衡后Y的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后Y的体积分数>a%的是
A.1molY,1molZ B.2mol X,1molY,1molN2
C.1molY和3molZ D.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
高温条件下反应达到平衡时的平衡常数 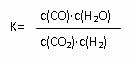 。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
。恒容条件下升高温度,H2浓度减小。则下列说法正确的是
A.反应的热化学方程式可表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 kJ/mol
CO2(g)+H2(g) △H<0 kJ/mol
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中以下物质的贮存方法,不正确的是( )
A.保存硫酸亚铁溶液时,要向其中加入少量硫 酸和铁粉
酸和铁粉
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
查看答案和解析>>
科目:高中化学 来源: 题型:
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
| 选项 | A | B | C | D |
| 实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸 | 用NaCl溶 液制备氯 化钠晶体 | 除去乙烯中少量SO2 |
| 实验仪器或装置 | 烧杯、玻璃 棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、氯水。
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | ____ | 存在Fe3+ |
Ⅱ.AgNO3的热稳定性
用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
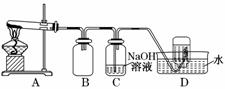
(2)装置B的作用是____________________________________________________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________________________
________________________________________________________________________。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是__①__(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有__②__。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例中没有发生氧化还原反应的是( )
A.配制生理盐水 B.燃放鞭炮
C.食物腐烂 D.高炉炼铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com