
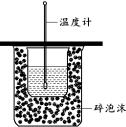
 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
分析 A.缺少环形玻璃棒;
B.滴入FeCl3溶液产生的气泡更快些,说明催化效果好;
C.应加入浓硫酸;
D.PH试纸要用干燥的,若湿润后相当于降低了溶液浓度.
解答 解:A.缺少搅拌装置环形玻璃棒,故A错误;
B.滴入FeCl3溶液产生的气泡更快些,说明催化效果好,可证明催化效果Fe3+>Cu2+,故B正确;
C.硫酸的浓度较小,应加入浓硫酸,故C错误;
D.PH试纸要用干燥的,测定溶液PH时不可湿润,否则相当于降低了溶液的浓度,故D错误.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.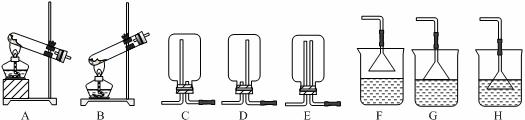
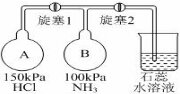
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
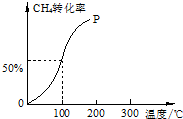 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
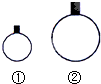
| A. | 常温常压下,相同物质的量的物质,其体积一定相等 | |
| B. | 常温常压下,用等质量的H2、CH4两种气体分别吹出如图所示的两个气球,其中①号气球内气体一定为CH4 | |
| C. | 任何条件下,等物质的量的氮气和一氧化碳所含的分子数、原子数不一定相等 | |
| D. | 1mol金属镁与其他物质发生化学反应,金属镁失去的电子数一定是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol丙烯酸含有NA个不饱和键 | |
| B. | 标准状况下,11.2L的苯中含有3NA个碳氢键 | |
| C. | 0.1mol/L的Na3PO4溶液中含有的阴离子总数大于0.1NA | |
| D. | 1L1.0mol/L的Na2SiO3溶液中含有的氧原子数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灯光变暗;二者电离常数相同 | B. | 灯光变暗;电离常数醋酸大于氨水 | ||
| C. | 灯光变亮;电离常数醋酸小于氨水 | D. | 灯光变亮;电离常数醋酸等于氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com