
一定体积的溶质质量分数为14%的氢氧化钾溶液,若将其蒸发掉50 g水后,其溶质的质量分数恰好增大1倍,溶液体积变为62.5 mL。则浓缩后溶液的物质的量浓度为( )。
A.2.2 mol·L-1 B.4 mol·L-1 C.5 mol·L-1 D.6.25 mol·L-1
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:填空题
锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示
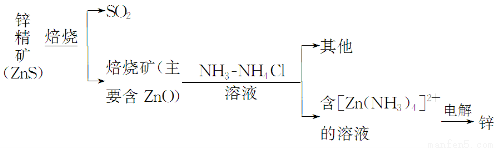
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。

查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是 ( )。
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是释放能量的反应
C.干冰气化需要吸收大量的热,这个变化是吸热反应
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3-、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是 ( )。
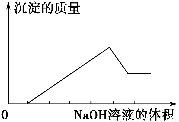
A.①②⑤ B.①③④ C.②⑥⑦ D.①②④⑥
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是( )。
溶液 | KOH | HNO3 | CH3COOH | HCl |
溶质质量分数w(%) | 56 | 63 | 60 | 36.5 |
物质的量浓度c(mol·L-1) | 14.3 | 13.8 | 10.6 | 11.8 |
A.HCl B.HNO3 C.CH3COOH D.KOH
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列叙述错误的是( )。
A.标准状况下,11.2 L氢气中含有1 mol质子
B.12 g金刚石含有的共价键数为4NA
C.46 g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题15有机化学基础选考练习卷(解析版) 题型:填空题
已知某芳香族化合物A的水溶液显酸性,遇FeCl3不显色,可发生下列转化(如图所示)。其中I为五元环状化合物;J可使溴水褪色;I和J互为同分异构体;K和L都是医用高分子材料。

请回答下列问题。
(1)A的结构简式为______________。
(2)写出下列反应的反应类型:反应③属于________反应,反应④属于________反应。
(3)写出反应②和⑤的化学方程式。
②_______________________________________________________________,
⑤______________________________________________________________。
(4)写出符合下列要求的G的同分异构体______________________________。
①含有苯环;②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH反应;④只能生成两种一氯代物。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是 ( )。
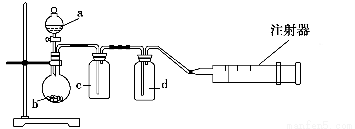
选项气体abcd
ASO2浓硫酸CuH2O浓硫酸
BCl2浓盐酸MnO2NaOH溶液浓硫酸
CNH3饱和
NH4Cl溶液消石灰空集气瓶固体NaOH
DNO稀硝酸铜屑H2O浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二1-2-3元素周期表元素周期律应用练习卷(解析版) 题型:选择题
下列关于化学观或化学研究方法的叙述中,错误的是( )
A.在化工生产中应遵循“绿色化学”的思想
B.在过渡元素中寻找优良的催化剂
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com