
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。
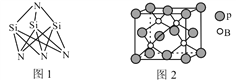
(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
【答案】 BBr3 + PBr3 + 3H2 ![]() BP + 6HBr 5 M 分子 > SO42-、ClO4- 等合理答案
BP + 6HBr 5 M 分子 > SO42-、ClO4- 等合理答案 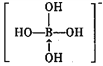 N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N—Si—N的键角为109.5;而一个N原子与3个Si原子成键,N上一对孤对电子对成排斥力大于成键电子,压缩了Si—N—Si的键角 面心立方最密
N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N—Si—N的键角为109.5;而一个N原子与3个Si原子成键,N上一对孤对电子对成排斥力大于成键电子,压缩了Si—N—Si的键角 面心立方最密 ![]()
【解析】(1)①根据反应条件和反应物、生成物书写方程式为BBr3+PBr3+3H2![]() BP+6HBr,故答案为:BBr3+PBr3+3H2
BP+6HBr,故答案为:BBr3+PBr3+3H2![]() BP+6HBr;
BP+6HBr;
②P原子核外有1s、2s、2p、3s、3p五种能级,一种能级有一种能量的电子;电子占据的最高能层符号为M,故答案为:5;M;
③分子晶体熔沸点较低,常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该晶体熔沸点较低,说明为分子晶体,故答案为:分子;
(2)①酸的酸性越强,该酸溶液的pKa越小,酸性:BrCH2COOH>CH3COOH,据此推测取代原子得电子能力越强酸性越强,可知酸性AtCH2COOH<ClCH2COOH,则pKa:AtCH2COOH>ClCH2COOH,故答案为:>;
②等电子体的结构和键合形式相同,则与磷酸根离子互为等电子体的微粒为SO42-、ClO4-等合理答案,故答案为:SO42-、ClO4-等合理答案;
③硼酸电离方程式为B(OH)3+H20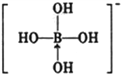 +H+,据此书写其电离出阴离子结构式为
+H+,据此书写其电离出阴离子结构式为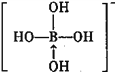 ,故答案为:
,故答案为: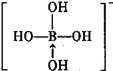 ;
;
(3)N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N-Si-N的键角为109.5°,而一个N原子与3个Si原子成键,N上还有一对孤对电子,孤电子对与成键电子对间的排斥力大于成键电子对之间的排斥力,所以Si-N-Si的键角更小,
故答案为:N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N—Si—N的键角为109.5;而一个N原子与3个Si原子成键,N上一对孤对电子对成排斥力大于成键电子,压缩了Si—N—Si的键角。
(4)根据图知,该晶胞是面心立方最密堆积,若该晶体中最邻近的两个P原子之间的距离为anm,晶胞的棱长= ![]() anm,该晶胞中P原子个数
anm,该晶胞中P原子个数![]() B原子个数为4,晶胞密度
B原子个数为4,晶胞密度 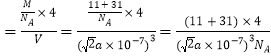 故答案为:面心立方最密;
故答案为:面心立方最密;![]()


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废水需处理与检测。
I.已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)ΔH1
H2(g)+2O2(g)=H3AsO4(s)ΔH1
H2(g)+![]() O2(g)=H2O(l)ΔH2
O2(g)=H2O(l)ΔH2
2As(s)+![]() O2(g) =As2O5(s)ΔH3
O2(g) =As2O5(s)ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH=_______________。
II.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
 已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为______;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是_______________; “二级沉砷”中H2O2与含砷物质反应的化学方程式为_________。
III.去除水体中的砷,将As(Ⅲ)转化为As(Ⅴ),也可选用NaClO实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题进行作答:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
D.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=______kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是(_____)。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______。下列各项能说明该反应达到平衡的是(______)。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定利用CO2对减少温室气体排放意义重大。CO2加氢合成甲醇是CO2综合利用的一条新途径。CO2和H2在催化剂作用下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
(1)测得甲醇的理论产率与反应温度、压强的关系如图所示。
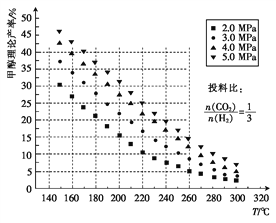
①下列措施能使CO2的转化率提高的是____(填序号)。
A.增大压强 B.升高温度 C.增大H2投料比 D.用更高效的催化剂
②在220℃、5.0MPa时,CO2、H2的转化率之比为___________。
③将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将_____(填“增大”“减小”或“不变”下同),CO2的转化率将_____。
④200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,,则此温度下该反应的平衡常数表达式K=_____________(只用数字填,不必计算出结果)。
(2)若H2(g)和CH3OH(l)的燃烧热分别为-285.8kJ·mol﹣1和-726.5kJ·mol﹣1,则由CO2和H2生成液态甲醇和液态水的热化学方程式为________________________________。
(3)甲醇电解法制氢气比电解水法制氢气的氢的利用率更高、电解电压更低。电解装置如图。
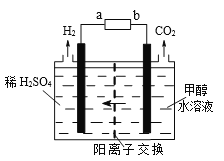
电源的正极为_____(填序号a或b)。其中阳极的电极反应式为_________________;标况下,每消耗1mol甲醇则生成H2的体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【有机化学基础】香料G的一种合成工艺如下图所示:
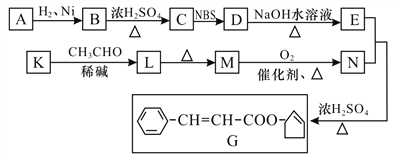
核磁共振氢谱显示A有两种峰,且峰面积之比为1∶1,且不含C=C。
已知:CH3CH2CH==CH2![]() CH3CHBrCH==CH2
CH3CHBrCH==CH2
CH3CHO+CH3CHO![]() CH3CHOHCH2CHO
CH3CHOHCH2CHO
CH3CHOHCH2CHO![]() CH3CH==CHCHO+H2O
CH3CH==CHCHO+H2O
请回答:
(1)A的结简式为_______________,G中除苯环外官能团的名称为___________________。
(2)检验M已完全转化为N的实验操作和现象是:_______________,则M已完全转化为N。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_____________。
(4)K→L的化学方程式为___________________________,反应类型为______________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种(不考虑立体异构):①能发生银镜反应,②能与溴的四氯化碳溶液加成,③苯环上有2个取代基;这些同分异构体中,其中不含甲基、碳原子在苯环两侧对称分布的同分异构体的结构简式为__________________。
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选):__________【请用以下方式表示:A![]() B…
B…![]() 目标产物】。
目标产物】。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2(g)+3H2(g)2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
A.1.2mol/(Lmin)
B.1.8 mol/(Lmin)
C.0.6mol/(Lmin)
D.2.4mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.含有共价键的物质一定是共价化合物
B.只含有共价键的物质一定是共价化合物
C.含有离子键的物质一定是离子化合物
D.氦分子中含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com