
����Ŀ���ɷ����Ʊ�FeCl2���ⶨFeCl2�ĺ�������Ҫ����������ʾ��

I.����ͼ��ʾ�����Ʊ�FeCl3��6H2O��
(1)�����ӷ���ʽ��ʾ���̢���ϡ��������ã�_________________________��
(2)�ڹ��̢���Ҫ��������Һ�в������ᣬĿ����___________________��
(3)����۵IJ�����_______________________ ��
��.��FeCl3��6H2O�Ƶø���FeCl2�Ĺ���������ʾ��
����ʢ��FeCl3��6H2O�������м���SOCl2�����ȣ������ˮFeCl3��
������ˮFeCl3���ڷ�Ӧ���У�ͨ����̢��в���������һ��ʱ�����ȣ�����FeCl2;
���ռ�FeCl2�����汸�á�
(4)��������2�в���FeCl2�Ļ�ѧ����ʽ��________________________��
��.�ⶨFeCl2�ĺ�����
������������ȡa g��Ʒ���Ƴ�100 mL��Һ;������Һ����ȡ������Һ5.00 mL������500 mL����ƿ�ڲ���ˮ200 mL;�ۼ���������Һ20.00mL����0.1 mol/L���Ը�����ر���Һ�ζ����յ�ʱ�������Ը�����ر���ҺV mL��
(5)�ζ��յ���ж�������______________________��
(6)�ζ�ʱ��������������̺������²ⶨ���ƫ�ߣ�����������̿�ʹ�ⶨ���ȷ��ԭ�������_____________________ ��
(7)��������Һ��![]() (FeC12) (g/L) =kV(ʽ��V�������ĵ����Ը�����ر���Һ�ĺ�����)����k=_____________(������λ��Ч����)��
(FeC12) (g/L) =kV(ʽ��V�������ĵ����Ը�����ر���Һ�ĺ�����)����k=_____________(������λ��Ч����)��
���𰸡�3Fe2++N03- +4H+ = 3Fe3++N0��+2H2O ����H+ʹN03- ��������Fe2+ֱ��N03- ��ȫ�������Ȳ�����Fe(N03)3�ֲ������������� �����������ᣬ����(Ũ��)��(��ȴ)�ᾧ������(ϴ�ӡ�����) 2FeC13+H2 ![]() 2FeCl2+2HC1 ���һ�����Ը�����ر���Һ��������ɫ��30s�ڲ���ʧ ����������ֹ����������������� 12.70
2FeCl2+2HC1 ���һ�����Ը�����ر���Һ��������ɫ��30s�ڲ���ʧ ����������ֹ����������������� 12.70
��������
I.��1��������������������������²���������������Ϊ�����ӣ�
��2���������ᣬ����H+ʹNO3-��������Fe2+ֱ��NO3-��ȫ���ļȲ�����Fe(NO3)3�ֲ������������ʣ�
��3������۴��Ȼ�����Һ��ȡFeCl3��6H2O���壬Ҫ��ֹˮ����
��.��4���Ȼ�����������Ӧ�����Ȼ������ķ�Ӧ����ʽ��
��. (5) �����Ը�����ر���Һ�ζ�FeCl2��Һ��������Ӧ�����ӷ���ʽΪ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O���յ�ʱ�Ϻ�ɫ��ɫ��
(6)��Һ�д���Cl-�����������̴���ʱ������ֹ����������������ӣ�
(7)���ݸ�����غ��Ȼ�������Ӧ�Ķ�����ϵ���㡣
I.��1��ϡ�����ܹ����������������������ӣ���Ӧ�����ӷ���ʽΪ��3Fe2++NO3- +4H+ = 3Fe3++NO��+2H2O��
�ʴ�Ϊ��3Fe2++NO3- +4H+ = 3Fe3++NO��+2H2O��
��2���ڸù�����Ҫ��������Һ�в������ᣬ���Բ���H+ʹNO3-��������Fe2+ֱ��NO3- ��ȫ���ģ��Ȳ�����Fe(NO3)3�ֲ���������������
�ʴ�Ϊ������H+ʹNO3-��������Fe2+ֱ��NO3- ��ȫ���ģ��Ȳ�����Fe(NO3)3�ֲ���������������
��3������۴��Ȼ�����Һ��ȡFeCl3��6H2O���壬Ҫ��ֹˮ�����ʲ����Ǽ����������ᣬ����(Ũ��)��(��ȴ)�ᾧ������(ϴ�ӡ�����)��
�ʴ�Ϊ�������������ᣬ����(Ũ��)��(��ȴ)�ᾧ������(ϴ�ӡ�����)��
��.��4���Ȼ�����������Ӧ�����Ȼ���������Ӧ�Ļ�ѧ����ʽΪ��2FeC13+H2 ![]() 2FeCl2+2HC1��
2FeCl2+2HC1��
�ʴ�Ϊ��2FeC13+H2 ![]() 2FeCl2+2HC1��
2FeCl2+2HC1��
��. (5) �����Ը�����ر���Һ�ζ�FeCl2��Һ��������Ӧ�����ӷ���ʽΪ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O���յ�ʱ�Ϻ�ɫ��ɫ���ζ��յ���ж������ǣ����һ�����Ը�����ر���Һ��������ɫ��30s�ڲ���ʧ��
�ʴ�Ϊ�����һ�����Ը�����ر���Һ��������ɫ��30s�ڲ���ʧ��
(6) �ζ�ʱ��������������̺������²ⶨ���ƫ�ߣ���������Һ�д���Cl-����������������������̿�ʹ�ⶨ���ȷ��ԭ�����������ֹ����������������ӣ�
�ʴ�Ϊ������������ֹ����������������ӣ�
(7)���ݷ�Ӧʽ��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��5.00 mL��Ʒ��Һ����0.1 mol/L���Ը��������ҺVmL����![]() (FeC12) (g/L)=
(FeC12) (g/L)=![]() =12.70Vg/L������
=12.70Vg/L������![]() (FeC12) (g/L) =kV�����k=12.70��
(FeC12) (g/L) =kV�����k=12.70��
�ʴ�Ϊ��12.70��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����100mL���Ȼ���14.6g��������Һ�У�����5.6g�����ۣ���Ӧ���е�2minĩ�ռ�������1.12 L(��״��)���ڴ˺��־���4min��������ȫ�ܽ⡣����������Һ����ı仯����
(1)ǰ2min����FeCl2��ʾ��ƽ����Ӧ������______________��
(2)��4min����HCl��ʾ��ƽ����Ӧ������________________��
(3)ǰ2min���4min��ȣ���Ӧ����__________�Ͽ죬��ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A(s)��B(g) ==3C(g)��4D(g)��Ӧ�У���ʾ�÷�Ӧ����������
A. ��(A)��1.5 mol��L1��s1B. ��(B)��0.5 mol��L1��s1
C. ��(C)��0.8 mol��L1��min1D. ��(D)��4mol��L1��min1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ��pH��7��(NH4)2SO4��NH3��H2O�Ļ����Һ�У�c(NH4��)��c(SO42��)֮����
A.С��2��1B.����2��1C.����2��1D.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y![]() M��N��Ӧ�е������仯������ͼ���������й�˵����ȷ����
M��N��Ӧ�е������仯������ͼ���������й�˵����ȷ����
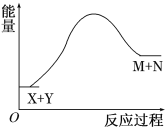
A. X������һ������M��������Y������һ������N������
B. �ƻ���Ӧ���еĻ�ѧ�������յ����������γ��������л�ѧ�����ų�������
C. ��Ϊ�÷�ӦΪ���ȷ�Ӧ����һ��Ҫ���ȷ�Ӧ���ܽ���
D. ����������ɼ�СM+N��X+Y���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������·�Ӧ��CO2(g)+H2(g) ![]() CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ��ѧƽ�ⳣ���ı���ʽ��K=_______________________________��
��2���÷�ӦΪ________(����ȡ����ȡ�)��Ӧ��
��3������˵������˵���÷�Ӧ��ƽ��״̬����__________
A��������ѹǿ����
B�����������c(CO)����
C�����������ܶȲ���
D��c(CO) = c(CO2)
E����λʱ��������CO�ķ�����������H2O�ķ��������
��4��ij�¶��£������ʵ�ƽ��Ũ�ȷ�����ʽ��c(CO2)��c(H2)=c(CO)��c(H2O)�����д�ʱ���¶�Ϊ__________�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ���������ֵΪNA������˵����ȷ����
A. pH=3��������Һ������H+����ĿΪ10-3NA
B. 7.8g Na2O2������SO2��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0. 1NA
C. ��״���£�11.2 L�����к��еĹ��õ��Ӷ���ĿΪ5NA
D. 0.1mol NH3��0.1 mol HC1���ܱ������г�ַ�Ӧ������ķ�������Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴ӦX(g)��2Y(g)![]() Z(g) ��H ��0��һ���¶��£������Ϊ2 L���ܱ������м���4 mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ����( )
Z(g) ��H ��0��һ���¶��£������Ϊ2 L���ܱ������м���4 mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ����( )

A. ����������м���1molX��2molY����ƽ��ʱ��X��ƽ��Ũ��С��0.125mol/L
B. a������Ӧ���ʴ����淴Ӧ����
C. ��Ӧ��ƽ��ʱ�������¶ȿ���ʵ��c��d��ת��
D. �������£���Ӧ��ƽ��ʱ��ƽ�ⳣ��K=3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com