
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题

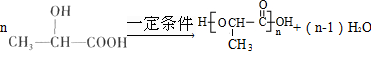 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
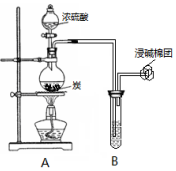 某小组同学利用如图装置开展实验,请回答:
某小组同学利用如图装置开展实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
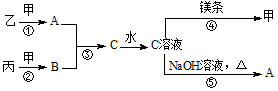 甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,各物质之间存在如图所示的转化关系(部分反应条件及产物略去):
甲、乙、丙均为中学化学常见的气体单质,A为10电子化合物,B为18电子化合物,各物质之间存在如图所示的转化关系(部分反应条件及产物略去): .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
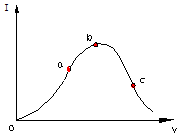 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与HBr反应 | B. | 1,3-丁二烯与溴以1:1反应 | ||
| C. | 苯与液溴混合物中加入铁粉 | D. | 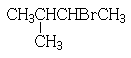 与KOH的醇溶液反应 与KOH的醇溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com