
| A. | 用润湿的pH试纸测稀酸溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内有气泡,终点读数时无气泡,所测体积偏小 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 |
分析 A.润湿的pH试纸测稀酸溶液,稀释了溶液,溶液酸性减弱;
B.用容量瓶配制溶液,定容时俯视刻度线,导致溶液体积偏小;
C.滴定前滴定管内有气泡,终点读数时无气泡,导致计算时滴定管内液体体积偏大;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,会有部分热量散失.
解答 解:A.润湿的pH试纸测稀酸溶液,稀释了溶液,溶液酸性减弱,测定溶液pH偏大,故A错误;
B.用容量瓶配制溶液,定容时俯视刻度线,导致溶液体积偏小,溶质的物质的量不变,则溶液浓度偏大,故B正确;
C.滴定前滴定管内有气泡,终点读数时无气泡,导致计算时滴定管内液体体积偏大,则所测体积偏大,故C错误;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,会有部分热量散失,所以测定结果偏小,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及误差分析,明确实验原理及基本操作规范性是解本题关键,注意操作不当会引起哪些物理量不变,易错选项是C.


科目:高中化学 来源: 题型:解答题
| 序号 | 名称 | 化学式 | △H(kJ•mol-1) |
| ① | 石墨 | C(s) | -393.5 |
| ② | 金刚石 | C(s) | -395.4 |
| ③ | 氢气 | H2(g) | -285.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、过滤、蒸馏 | B. | 过滤、蒸馏、分液 | C. | 分液、蒸馏、过滤 | D. | 蒸馏、过滤、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
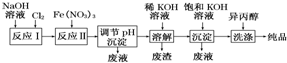
| A. | 反应Ⅰ主要为2NaOH+Cl2═NaCl+NaClO+H2O 反应Ⅱ的离子方程式为3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O | |
| B. | 加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 调节pH析出的沉淀为高铁酸钠,用异丙醇洗涤的主要目的是有利于产品干燥 | |
| D. | 高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3有吸附性,有絮凝作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PCl3和Cl2在一定条件下反应生成PCl5.
PCl3和Cl2在一定条件下反应生成PCl5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+) | |
| B. | 1 L0.l mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(X-)>c(H+)>(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质 | B. | 元素 | C. | 分子 | D. | 氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com