
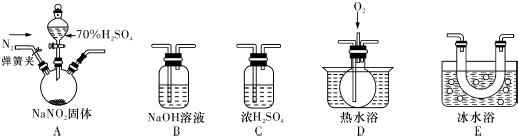
分析 (一)(1)根据各部分装置的作用进行连接,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮;
(2)NO很容易被氧气氧化,装置中有空气,无法检验有NO生成;
(3)根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断,温度低于二氧化氮液化温度时,二氧化氮变成液态;
(4)根据反应物和生成物写出反应方程式;
(二)(1)据溶度积小的沉淀先沉淀;
(2)NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;
(三)菜中含有少量的亚硝酸盐.现取1kg泡菜榨汁,将榨出的液体收集后,经处理,使得到的泡菜汁中的亚硝酸盐都转化为亚硝酸钠.向得到的泡菜汁中加入过量的稀硫酸和碘化钾溶液,发生如下反应:2NaNO2+2H2SO4+2KI=2NO↑+I2+K2SO4+Na2SO4+2H2O,反应后生成5.08g I2,根据化学方程式定量关系计算得到亚硝酸钠质量,当人体一次性摄取超过300mg亚硝酸钠时,就会引起中毒,据此判断是否会引起中毒.
解答 解:(一)(1)NO很容易被氧气氧化,装置中有空气,无法检验有NO生成,所以通氮气的目的是排尽整个装置中的空气,防止产生的NO被氧化生成NO2,
故答案为:防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验的干扰;
(2)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以装置的连接为A→C→E→D→B,
故答案为:E;D;B;
(3)①D中无色气体变成红色,说明含有NO气体,故答案为:D中通入氧气后,出现红棕色气体;
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,故答案为:冷凝使NO2完全液化;
(4)通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应方程式为2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O,
故答案为:2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O;
(二)(1)Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10,分别向盛有5mL 0.0001mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成AgCl沉淀;
故答案为:NaCl;
(2)由于亚硝酸钠溶液中存在水解平衡:NO2-+H2O=HNO2+OH-,所以亚硝酸钠溶液显示碱性,
故答案为:NO2-+H2O?HNO2+OH-;
(三)(1)设1kg菜汁中含有NaNO2的质量为y,2NaNO2+2H2SO4+2KI=2NO+I2+K2SO4+Na2SO4+2H2O
138 254
y 5.08g
y=2.76g,
故答案为:2.76;
(2)0.1kg泡菜中含有NaNO2的质量为2.76 g/kg×0.1 kg=0.276g=276mg,当人体一次性摄取超过300mg亚硝酸钠时,就会引起中毒
因为276mg<300mg,所以不会引起中毒,
故答案为:否.
点评 本题考查实验方案设计,明确物质的性质和实验原理是解本题关键,注意实验设计要遵循严密性、可行性、科学性的原则,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v(D)=30 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: | 1小时 | 2 小时 | 3小时 | 4小时 |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3•H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③=④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
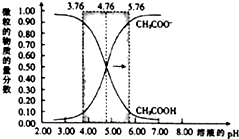 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )| A. | 当溶液pH=3.76时,c(CH3COOH)>c(CH3COO-) | |
| B. | 当溶液pH=4.76时,c(CH3COO-)=c(CH3COOH)>c(OH-)=c(H+) | |
| C. | 当溶液pH=5.76时,CH3COO-的物质的量分数约为0.91 | |
| D. | 当溶液3<pH<7时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=10(pH-pKa) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚与碳酸钠溶液反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]+$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-═Ag2S↓ | |
| B. | 向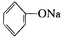 溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- 溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com