
【题目】(1)固体可分为晶体、非晶体和准晶体三大类,可通过________________方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为_______________。
(2)PCl3的立体构型为______________,中心原子的杂化轨道类型_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是___________________。
②B、C、N、O三种元素第一电离能由小到大的顺序为___________。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:____________。
(4)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
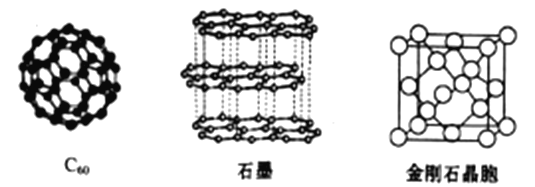
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的________共价键,而石墨层内的C-C间存在_________键。
②金刚石晶胞含有___________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率__________(不要求计算结果)。
【答案】 X-射线衍射 [Ar]3d54s2 三角锥形 sp3 分子结构相似,相对分子质量增大,分子间作用力逐渐增强 B<C<O<N BF3分子中硼原子有空轨道,F-有孤对电子,能通过配位键形成BF4- σ σ、π 8 ![]()
【解析】(1)固体可分为晶体、非晶体和准晶体三大类,可通过X-射线衍射方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。锰是25号元素,基态Mn原子的电子排布式为[Ar]3d54s2,故答案为:X-射线衍射; [Ar]3d54s2;
(2)PCl3中P原子与3个氯原子相连,含有1个孤电子对,立体构型为三角锥形,中心原子的杂化轨道类型为sp3杂化,故答案为:三角锥形;sp3;
(3)①硼的四种卤化物均为分子晶体,且分子结构相似,相对分子质量逐渐增大,分子间作用力逐渐增强,沸点依次升高,故答案为:分子结构相似,相对分子质量增大,分子间作用力逐渐增强;
②同一周期,从左到右,元素的第一电离能逐渐增大,但N原子的2p为半充满结构,均为稳定,第一电离能最大,B、C、N、O三种元素第一电离能由小到大的顺序为B<C<O<N,故答案为:B<C<O<N;
③BF3分子中硼原子有空轨道,F-有孤对电子,能通过配位键形成BF4-,因此反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生,故答案为:BF3分子中硼原子有空轨道,F-有孤对电子,能通过配位键形成BF4-;
(4)①金刚石中碳原子以sp3杂化,形成四条杂化轨道,全部形成σ键;石墨中碳原子以sp2杂化,形成三条杂化轨道,还有一条为杂化的p轨道,三条杂化轨道形成σ键,而未杂化p轨道形成π键,故答案为:σ;σ;π;
②晶胞中顶点微粒数为:8×![]() =1,面心微粒数为:6×
=1,面心微粒数为:6×![]() =3,体内微粒数为4,共含有8个碳原子;晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即
=3,体内微粒数为4,共含有8个碳原子;晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即![]() a=8r,r=
a=8r,r=![]() a;碳原子的体积为:8×
a;碳原子的体积为:8×![]() ×π×r3,晶胞体积为:a3,碳原子的空间利用率为:
×π×r3,晶胞体积为:a3,碳原子的空间利用率为:![]() =
=![]() =
= =
=![]() ,故答案为:8;
,故答案为:8;![]() 。
。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
A. x=1
B. B的转化率为40%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”,常用于催化剂和新型电池。钒(V)在溶液中主要以VO43-(黄色)、VO2+(浅黄色)、VO2+ (蓝色)、V3+(绿色)、V2+(紫色)等形式存在。回答下列问题:
(1)已知:4Al(s)+3O2(g)=2Al2O3(s) △H1 4V(s)+5O2(g)=2V2O5(s) △H2
写出V2O5与Al 反应制备金属钒的热化学方程式__________________。(反应热用△H1、△H2表示)
(2) V2O5具有强氧化性,溶于浓盐酸可以得到蓝色溶液(含有VO2+),试写出V2O5与浓盐酸
反应的化学反应方程式:_________________________________。
(3)VO43-和V2O74-在pH≥13的溶液中可相互转化。室温下,1.0mol·L-1的Na3VO4溶液中c(VO43-)随c(H+)的变化如图所示。溶液中c(H+)增大,VO43-的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算该转化反应的平衡常数的数值为________。
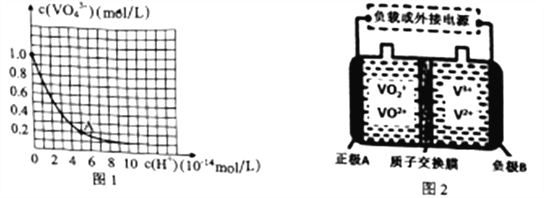
(4)全钒液流电池是一种优良的新型蓄电储能设备,其工作原理如图2所示:
①放电过程中,A电极的反应式为___________________。
②充电过程中,B电极附近溶液颜色变化为___________________。
③若该电池放电时的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用率为______________(写出表达式,不必计算出结果。已知:电量Q=It,t为时间/秒;电解时Q=znF,z为每摩尔物质得失电子摩尔数,n为物质的量,法拉弟常数F=96500C/mol,电流利用效率=![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g)![]() CH3OH(g) ΔH。
CH3OH(g) ΔH。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
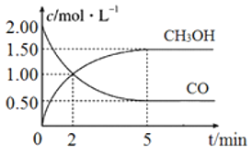
①从反应开始到2 min,用氢气表示的平均反应速率v(H2)=__________。
②下列说法正确的是______________(填字母序号)。
A.达到平衡时,H2的转化率为75%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.35molCO气体,则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)工业上另一种合成甲醇的方法是利用CO2和H2,己知:CH3OH、H2的燃烧热(ΔH)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是______________________。
(4)CH3OH(l)作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某未知溶液中是否含有SO42-的下列操作中,最合理的是()
A.先加硝酸酸化,再加氯化钡溶液B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液D.先加盐酸酸化,再加硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中有浓度均为0.01molL﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38;Ksp[Cr(OH)3]=7.0×10﹣31 , Ksp[Zn(OH)2]=1.0×10﹣17;Ksp[Mg(OH)2]=1.8×10﹣11 . 当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com