
| A. | 硅 | B. | 磷 | C. | 硫 | D. | 氯 |
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. | 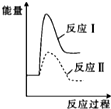 | C. | 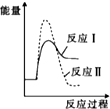 | D. | 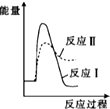 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
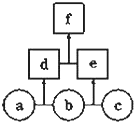 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )| A. | d和e分子中所有原子都不满足8电子结构 | |
| B. | 单质c的氧化性强于单质a | |
| C. | 相同状况下,单质c、a、b的沸点逐渐减小 | |
| D. | f可电离生成两种含10个电子的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=30 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z>Y | |
| B. | X与W能形成共价化合物 | |
| C. | Y与Z组成的化合物溶于水呈酸性 | |
| D. | 元素X、Y、W的最高化合价均与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 7 | 9 | ||
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
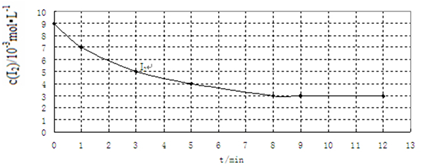
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com