
| ʵ�鲽�� | ʵ����� | ʵ������ |
| �� | ����Ӧ��õ���ɫ��ĩX���ٶ�Ϊ���ȵģ���ȡ������������һ�Թ��У������������ᣬ�� | ��ɫ��ĩ���ܽ⣬��Һ��dz��ɫ�����������ݲ��� |
| �� | ��ʵ��I�еõ�����Һ�μӼ���KSCN��Һ���� | ��Һû�г���Ѫ��ɫ |
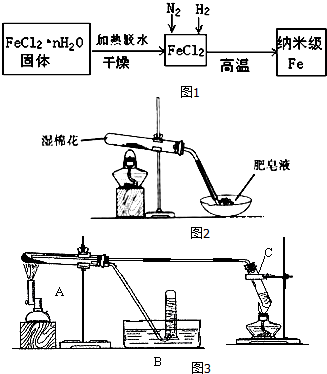
���� I�����ᾧˮ���Ȼ�����������ˮ�õ�FeCl2��N2��H2��FeCl2�ڸ��������µõ�����Fe�������Ļ�ѧ��ӦΪFeCl2+H2$\frac{\underline{\;����\;}}{\;}$Fe+2HCl��
��1����������ͼ��֪���ڸ�����������������ԭ�Ȼ������ɵ�����Fe��
��2����Ӧ���ʱ����Խ��Ӧ����Խ�죻
��3��FeCl2•nH2O���������ˮʱ������������ˮ�������������������Ȼ��⣬Ϊ��ֹˮ����Խ�����HCl��Χ�м��ȣ�
II����4��Fe����ˮ�����ڼ��������·�Ӧ����FeO��������
��5��װ��C�����Ʊ�ˮ������
��6�������۹�������������Fe3+��
��7������ˮ������Ӧ������������������������Ϲ������������ж�������ɷ֣�
��� �⣺I�����ᾧˮ���Ȼ�����������ˮ�õ�FeCl2��N2��H2��FeCl2�ڸ��������µõ�����Fe�������Ļ�ѧ��ӦΪFeCl2+H2$\frac{\underline{\;����\;}}{\;}$Fe+2HCl��
��1����������ͼ��֪���ڸ�����������������ԭ�Ȼ������ɵ�����F����Ӧ����ʽΪFeCl2+H2$\frac{\underline{\;����\;}}{\;}$Fe+2HCl���ʴ�Ϊ��FeCl2+H2$\frac{\underline{\;����\;}}{\;}$Fe+2HCl��
��2������Fe��������Ӵ������Ӧ���ʿ죬��������Fe���ڿ���������ȼ�ɺ�ɫ���壬�����е���˿�����۱������С�����Ժ��ѷ�Ӧ��
�ʴ�Ϊ������Fe��������Ӵ������Ӧ���ʿ죻
��3��FeCl2•nH2O���������ˮͨʱ������������ˮ�������������������Ȼ��⣬Ϊ��ֹFeCl2ˮ�⣬FeCl2•nH2O���������ˮͨ��Ҫͨ������HCl���壬HCl������FeCl2ˮ�⣬��ͨ���HCl����ɴ���ˮ����������FeCl2•nH2O������ˮ��
�ʴ�Ϊ�������HCl���壻 HCl������FeCl2ˮ�⣬��ͨ���HCl����ɴ���ˮ������
��4��Fe����ˮ�����ڼ��������·�Ӧ����FeO������������ʽΪFe+H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$FeO+H2��
�ʴ�Ϊ��Fe+H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$FeO+H2��
��5����Ӧ��Ϊ����ˮ��������װ��C�����Ʊ�ˮ�������ʴ�Ϊ����ȡˮ������
��6�������۹�������������������Ӧ�����������ӣ���Ӧ����ʽΪ��2Fe3++Fe=3Fe2+������ȷ���Ƿ�ΪFeO���ʴ�Ϊ��2Fe3++Fe=3 Fe2+��
��7��3Fe+4H2O�TFe3O4 +4H2 Fe������Ϊ5.6g����n��Fe��=0.1mol�������ЩFe��ȫ��ˮ������Ӧ����ôӦ������$\frac{0.1}{3}$mol ��Fe3O4��m��Fe3O4��=$\frac{0.1}{3}$��M��Fe3O4��=7.73g����������ֻ������ 6.88g �� ���壬�ͱ��� Fe û����ȫ��Ӧ������ʣ�࣬��������ΪFe3O4��
�ʴ�Ϊ��Fe3O4��
���� ���⿼�������Ʊ���Ϊ��Ƶ���㣬�漰����ʽ�ļ��㡢������ԭ��Ӧ�����ӷ�Ӧ����Ӧ����Ӱ�죬������ѧ���ķ���������ʵ�������ͼ��������Ŀ��飬���ո���������ˮ��Ӧ��ʵ����װ�õ�����Ϊ���Ĺؼ�����Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH��Һ | B�� | AgNO3��Һ | C�� | Ba��OH��2��Һ | D�� | BaCl2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
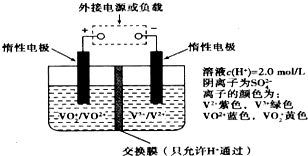 ����Դ�ͻ�����ѹ���£�����Դ�綯�������ɽ���Ϊδ�������ķ�չ��������綯������ʹ�����ͷ���أ�һ���Գ��3-5���Ӻ����������ɴ�1000������ɱ����ֻ��Ŀǰ﮵�ص�40%������������ֱ���﮵�ص�$\frac{1}{25}$��$\frac{1}{10}$��ȫ��Һ�����ܵ�������ò�ͬ��̬���ӶԵ�������ԭ��Ӧ��ʵ�ֻ�ѧ�ܺ͵����ת����װ�ã���ԭ����ͼ��ʾ�������йظ÷���ص�˵������ȷ���ǣ�������
����Դ�ͻ�����ѹ���£�����Դ�綯�������ɽ���Ϊδ�������ķ�չ��������綯������ʹ�����ͷ���أ�һ���Գ��3-5���Ӻ����������ɴ�1000������ɱ����ֻ��Ŀǰ﮵�ص�40%������������ֱ���﮵�ص�$\frac{1}{25}$��$\frac{1}{10}$��ȫ��Һ�����ܵ�������ò�ͬ��̬���ӶԵ�������ԭ��Ӧ��ʵ�ֻ�ѧ�ܺ͵����ת����װ�ã���ԭ����ͼ��ʾ�������йظ÷���ص�˵������ȷ���ǣ�������| A�� | �������У�H+����ͨ�����ӽ���Ĥ�����ƶ����γɵ���ͨ·�����Ҳ���缫��Ӧ | |
| B�� | �ŵ�����У��Ҳ���Һ����Һ��ɫ����ɫ��Ϊ��ɫ | |
| C�� | �õ��Ϊ�����أ��������Һ���ɻƱ���ʱ��Ϊ�����̣���ʱ�����ҺpHֵ���� | |
| D�� | ���ʱ��ת�Ƶĵ�����Ϊ3.01��1023���������Һ��n��H+��������0.5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
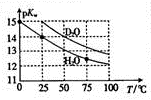 Hz0��D20��pKw ��pKw=-lgKw�����¶ȵĹ�ϵ��ͼ��ʾ�������й�˵����ȷ���ǣ�������
Hz0��D20��pKw ��pKw=-lgKw�����¶ȵĹ�ϵ��ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | D20�ĵ������Ϊ���ȹ��� | B�� | 25��ʱ����D20��pH����7 | ||
| C�� | 25��ʱ��pH=7��Һ��һ���Ǵ�H20 | D�� | �����£���Dz0�м���DCI��pKw��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����������ʵ���Ҫ���������ʽṹ����ش��������⣮
�����������ʵ���Ҫ���������ʽṹ����ش��������⣮| ������/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| ���Ӿ��� | NaCl | KCl | CaO |
| ������/kJ•mol-1 | 786 | 715 | 3401 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾA--E �������ʵ��ת����ϵ������AΪ����ɫ��ĩ��CΪ���ʣ�DΪ���ӻ����
��ͼ��ʾA--E �������ʵ��ת����ϵ������AΪ����ɫ��ĩ��CΪ���ʣ�DΪ���ӻ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �Թ� | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4���� |
| �� | 4mL | x mL | 1mL | �� |
| �� | y mL | 2mL | 1mL | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| H2CO3 | K${\;}_{{a}_{1}}$=4.3��10-7 | HClO | Ka=2.95��10-8 |
| K${\;}_{{a}_{2}}$=5.61��10-11 | AgCl | Ksp=1.77��10-10 | |
| CH3COOH | Ka=1.76��10-5 | Ag2CrO4 | Ksp=1.12��10-12 |
| I | �� | �� | �� | |
| FeCl3��Һ���/mL | 100 | 100 | 100 | 100 |
| �����ĩ����/g | 3 | 6.6 | 9 | 12 |
| ʣ���ĩ����/g | 0 | 0.64 | 3.2 | 6.4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com