
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | HCN+Na2CO3→NaHCO3+NaCN | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,据此分析解答.
解答 解:A.酸性HCO3-<HClO,所以少量二氧化碳通入NaClO溶液中发生的反应为:NaClO+CO2+H2O=NaHCO3+HClO,故A错误;
B.酸性HCO3-<HCN<H2CO3,所以过量的HCN滴入碳酸钠溶液中发生反应:HCN+Na2CO3=NaCN+NaHCO3,故B正确;
C.酸根离子水解程度越大,其结合质子能力越强,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,所以酸根离子结合质子能力大小顺序是CO32->CN->HCO3->CH3COO-,故C错误;
D.酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,故D错误;
故选B.
点评 本题考查了盐类水解,明确酸根离子水解程度与酸的电离平衡常数、相同浓度钠盐溶液pH大小的关系是解本题关键,再结合强酸制取弱酸来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
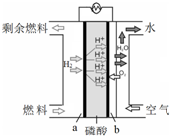
| A. | b极发生还原反应 | |
| B. | a极的反应式:H2+2OH--2e-═2H2O | |
| C. | 放电时,电子从b极经外电路流向a极 | |
| D. | 电池工作一段时间后,溶液中磷酸的浓度会升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑ | |
| B. | 硫酸铁溶液中通入硫化氢气体:2Fe3++3H2S→2FeS↓+S↓+6H+ | |
| C. | 铝与氢氧化钠溶液反应:Al+2OH-→AlO2-+H2↑ | |
| D. | 已知25℃时,电离常数Ki (苯甲酸)>Ki1(H2CO3)>Ki (苯酚)>Ki2(H2CO3).常温下将水杨酸(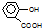 )与过量的Na2CO3溶液混合: )与过量的Na2CO3溶液混合: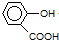 +2CO32-→ +2CO32-→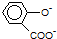 +2HCO3- +2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
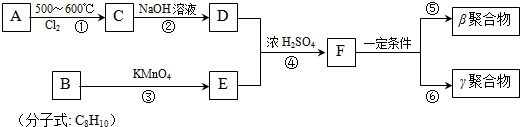
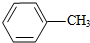 $\stackrel{MnO_{4}}{→}$
$\stackrel{MnO_{4}}{→}$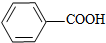
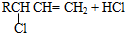 =CH2+HCl
=CH2+HCl
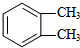 ,B苯环上的二氯代物的结构简式为:
,B苯环上的二氯代物的结构简式为: ,
, .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上式中缺项所填物质在反应中作氧化剂 | |
| B. | 在RO3-参与的氧化还原反应中,R元素只能被还原 | |
| C. | 上述反应中,转移电子数为5NA | |
| D. | 同周期主族元素原子中R的原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
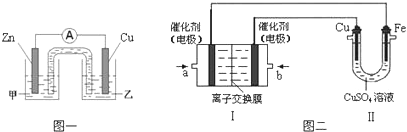
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| B. | 常温常压下,4.6 g NO2气体含有0.1NA个分子 | |
| C. | 常温下,1L0.50mol•L-1NH4Cl溶液与2L0.25 mol•L-1NH4Cl溶液含NH4+物质的量不同 | |
| D. | l mol•L-1的NaClO溶液中ClO-和HClO共NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com