
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q???? 184.8kJ(填“>”、“<”或“=”)。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是??????????? 。
a.3v逆(N2)=v正(H2)? ???????? b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 ???? d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
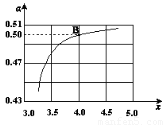
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是?????????? 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是?????????? 。
(3)图中的B点处,NH3的平衡转化率为?????? 。
(4)已知:? 3Cl2+2NH3→N2+6HCl????? ――①?? 3Cl2+8NH3→N2+6NH4Cl??? ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→?????????????????????? ――③
(1)<?????? a (共4分,各2分)
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大?? (2分)
(3)25% (2分)
(4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl?? (2分)
【解析】
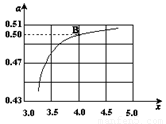
试题分析:(1)根据题给信息知,合成氨反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,合成氨的反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,生成的氨气小于2mol,故达平衡后放出的热量小于184.4 kJ;一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v逆(N2)=v正(H2),符合v正= v逆,正确;b.2v正(H2)= v正(NH3)两个反应速率均为正反应速率,错误;c.混合气体密度不随反应的进行而变化,不能作为平衡状态的依据,错误;d.平衡时c(N2):c(H2):c(NH3)不一定为1:3:2,错误;选a;(2)根据题给图像及信息分析,CO2平衡转化率(α)随着x增大而增大的原因是c(NH3)增大,平衡正向移动,所以CO2的转化率增大;(3)B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.50mol,依据化学方程式2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
考点:考查反应热的计算、可逆反应的特点、平衡标志及平衡图像、平衡计算及氧化还原方程式的书写。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
固氮有三种方式:生物固氮、工业合成氨和放电条件下氮气与氧气化合。全世界工业合成氮肥中的氮只占固氮总量的20%,其余绝大多数是通过生物固氮进行的,最常见的是豆科植物根部的根瘤菌,能将大气中游离态的氮经固氮酶的作用生成氮的化合物,以利于植物利用。
(1)根瘤菌与豆科植物的关系在生物学上称为__________________;
(2)根瘤菌之所以有固氮作用,是因为它有独特的固氮酶,而最根本原因是它含有独特的___________________;
(3)日本科学家把固氮基因转移到水稻根际微生物中,通过指导合成固氮所需的_____________进而引起固氮作用。更为理想的是直接将固氮基因转移到稻、麦等粮食及经济作物的细胞中,让植物本身直接固氮,这样可以免施氮肥。如果这种愿望实现的话说,那么固氮基因中遗传信息表达途径为___________________________________;
(4)这种生物固氮与工业合成氨比较,它是在_____________条件下进行的,从而节省了大量的器材、设备和能源;
(5)俗话说“雷雨发庄稼”,因为电闪雷鸣的雨天,氮气在空气中发生一系列的反应,产生了植物可利用的含氮化合物,写出有关的三个反应方程式____________________、____________________________、
____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市六校高三12月联考化学试卷(解析版) 题型:填空题
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l)。
CO(NH2)2
(l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)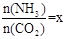 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com