下列说法正确的是( )
A.溶液中c(H+)>c(OH-),该溶液不一定显酸性
B.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体
C.主族元素的简单离子R2-和M+的电子层结构相同,则原子序数R>M
D.若相同温度和浓度的两种酸的酸性HA>HB,则钠盐溶液的碱性NaA<NaB
【答案】分析:A.溶液中c(H+)>c(OH-),溶液一定显酸性;
B.制备Fe(OH)3胶体,应在沸水中滴加饱和的FeCl3溶液;
C.根据质子数与核外电子数与电荷数的关系判断;
D.根据酸越弱,对应的盐溶液水解程度越大分析.
解答:解:A.溶液的酸碱性取决于溶液中H+和OH-浓度的大小关系,溶液中c(H+)>c(OH-),溶液一定显酸性,故A错误;
B.制备Fe(OH)3胶体,应在沸水中滴加饱和的FeCl3溶液,当溶液呈红棕色时停止加热,如用NaOH溶液,易生成沉淀,故B错误;
C.主族元素的简单离子R2-和M+的电子层结构相同,则Z(R)+2=Z(M)-1,原子序数M>R,故C错误;
D.酸越弱,对应的盐溶液水解程度越大,则若相同温度和浓度的两种酸的酸性HA>HB,则钠盐溶液的碱性NaA<NaB,故D正确.
故选D.
点评:本题考查溶液的酸碱性判断,盐类水解的应用等问题,题目难度中等,注意胶体的制备,为常考查点.




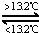 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,