
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅用于光导纤维 | |
| C. | SiO2不溶于水,也不溶于任何酸 | |
| D. | 用带玻璃瓶塞的试剂瓶盛放NaOH溶液 |
分析 A.晶体硅是良好的半导体材料;
B.硅是半导体材料;
C.SiO2不溶于水,但二氧化硅能和氢氟酸反应生成四氟化硅和水;
D.玻璃主要成分中的二氧化硅为酸性氧化物,具有酸性氧化物的通性能与碱反应.
解答 解:A.晶体硅是非金属材料,Si原子最外层电子为4个,既难得电子,也难失去电子,是良好的半导体材料,故A正确;
B.硅是半导体材料,二氧化硅是光导纤维的主要成份,故B错误;
C.SiO2不溶于水,但氢氟酸能与二氧化硅反应生成四氟化硅和水,反应的方程式为SiO2+4HF=SiF4↑+2H2O,故C错误;
D.用带玻璃瓶塞的试剂瓶盛放NaOH溶液,玻璃主要成分中的二氧化硅与烧碱反应生成硅酸钠和水,反应方程式为SiO2+2NaOH=Na2SiO3+H2O,生成的硅酸钠具有粘性,容易把玻璃塞和玻璃瓶粘在一起,故D错误;
故选A.
点评 本题主要考查了硅及其化合物的知识应用,题目难度不大,注意基础知识的积累,注意SiO2+2NaOH=Na2SiO3+H2O为高频考点.


科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度,CH3COOH的电离程度减小 | |
| B. | 加少量NaOH固体,CH3COOH的电离平衡向正方向移动 | |
| C. | 加少量0.2 mol/L 的HCl溶液,溶液中c(H+)增大,平衡向正方向移动 | |
| D. | 加少量CH3COONa固体,CH3COOH的电离平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.5mol | C. | 0.15mol | D. | 0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
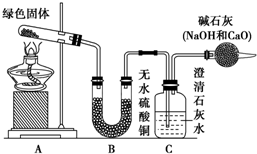 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有甲酸乙酯和甲酸 | B. | 有甲酸乙酯和乙醇 | ||
| C. | 有甲酸乙酯,可能有乙醇 | D. | 几种物质都有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、HCO3-、SO42- | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Mg2+、Na+、SO42-、NO3- | D. | Al3+、Ag+、OH-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
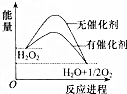 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+O2;△H=-Q1 kJ•mol-1 | |
| D. | 加入催化剂,减小了反应的热效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com