
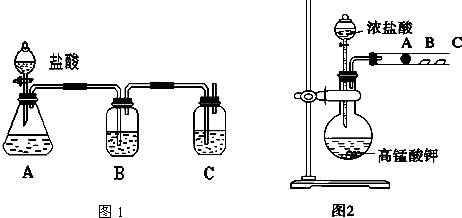


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、水属于非电解质 |
| B、氢氧两种元素只能组成水 |
| C、0℃时冰的密度比液态水的密度大 |
| D、标准状况下,18g水分子的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
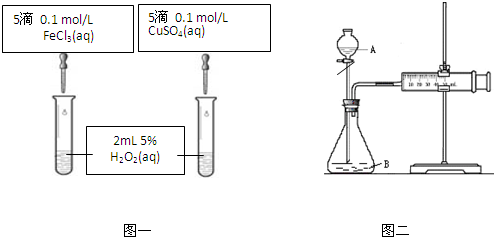
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3 mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
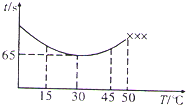 NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.
NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 30 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
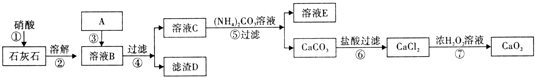
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液Y中铝元素的存在形式 | 溶液X中 | ||
| 一定存在的离子 | 一定不存在的离子 | 不能确定的离子 | |
| Al3+ | |||
| Cl- | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
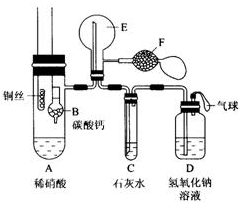 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为 一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去).B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为 一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com