
【题目】将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( ) 
A.该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存
B.该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存
C.向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图
D.向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图
【答案】D
【解析】解:将少量的铝投入过量的氢氧化钠溶液中充分反应,反应后溶液中存在AlO2﹣、OH﹣等,溶液呈碱性; A.碱性条件下Ag+、NH4+不能大量共存,分别生成沉淀、氨气等,故A错误;
B.碱性条件下,离子之间不发生任何反应,可大量共存,故B错误;
C.溶液呈碱性,向该溶液中逐滴加入AlCl3溶液,开始生成偏铝酸钠,后生成氢氧化铝沉淀,继续加入氯化铝,沉淀不溶解,故C错误;
D.向该溶液中逐滴加入稀盐酸,先发生中和反应,后生成氢氧化铝沉淀,最后氢氧化铝溶解,图象符合,故D正确.
故选D.
【考点精析】通过灵活运用铝的化学性质,掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应即可以解答此题.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】某研究小组为探究影响过氧化氢分解的因素,做了三个实验,相应的实验结果如图1所示(实验1、 实验2均在最适宜条件下进行,实验3其他条件适宜),请分析回答:
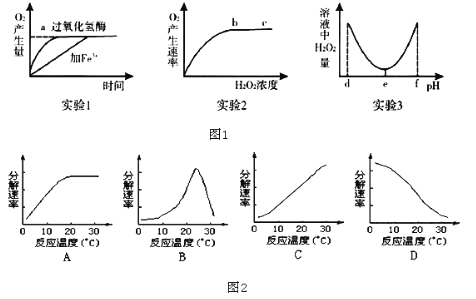
(1)实验1,2,3中的自变量分别为______、______、______。
(2)实验2结果反映,在b、c所对应的H2O2浓度范围内,过氧化氢溶液浓度会______(填“升高”“降低”或“不影响”)过氧化氢酶的活性,bc段O2产生速率不再增大的原因最可能是______。
(3)实验1若温度升高到10℃,加过氧化氢酶的催化反应曲线斜率将______(填“增大”或“减小”);加Fe3+的催化反应曲线斜率将______(填“增大”或“减小”)。
(4)实验3的结果显示,过氧化氢酶的最适pH为______,实验结果表明,当pH小于d或大于f时,过氧化氢的活性将永久丧失,其原因是______。
(5)如图2能正确表示温度对唾液淀粉酶活性影响曲线的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①碳酸钠 ②氧化钠 ③二氧化硅 ④铁 ⑤氧气⑥氢氧化钙 ⑦硫酸 请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于单质的是 , 属于氧化物的是 , 属于酸的是 , 属于碱的是 , 属于盐的是 .
(2)写出①分别与⑥、⑦在溶液中反应的离子方程式:、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究温度和pH对某酶促反应速率的影响,经实验得到如图所示的曲线。据此图分析,回答下列问题。
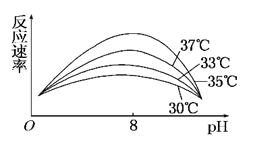
(1)该酶催化反应的最适温度为 左右。
(2)当pH为8时,影响反应速率的主要因素是 。
(3)本实验中需控制的无关变量是 (至少写出两个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (2017·湖南省怀化市普通高中学生学业水平模拟考试)下列行为符合化学实验安全要求的是
A.做实验剩余的金属钠直接丢弃在废液缸中
B.配制稀硫酸时,将水缓慢倒入浓硫酸中并不断搅拌
C.点燃CH4前,检验气体的纯度
D.大量有毒氯气(密度比空气大)氯气泄漏时,迅速离开现场并尽量往低处去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究. 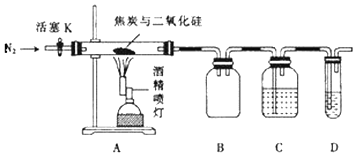
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O═CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊).
(1)实验的主要步骤如下: ①点燃酒精喷灯
②检查装置的气密性
③通入N2一段时间
④向A的硬质玻璃管中装入焦炭(过量)与二氧化硅混合物共m g则正确的操作顺序是 .
(2)实验时要通入足够长时间的N2 , 其原因是 .
(3)装置D中所盛试剂为(填序号)
A.NaOH溶液
B.Ca(OH)2溶液
C.PdCl2溶液
D.稀H2SO4溶液
(4)若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则A中反应的化学方程式为 . 实验结束后,C装置增重ng,求m g混合物中SiO2的质量分数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)磁性氧化铁的化学式________ ;写出铁与水蒸气反应的化学方程式_____________
(2)过氧化钠是___色固体;可用于 ________;其中氧元素的化合价___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( ) 
A.混合酸中NO3﹣物质的量为0.2mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+ , BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为4molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com