
科目:高中化学 来源: 题型:
难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)![]() Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) ![]() 2Ag++
2Ag++![]() 。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(
。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(![]() )=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
)=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
(1)Cl-、![]() 谁先沉淀?
谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南通市通州区高三4月查漏补缺专项检测化学试卷(带解析) 题型:计算题
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三“联测促改”活动理综化学试卷(解析版) 题型:填空题
某火电厂的脱硫尾气通入饱和K2CO3溶液吸收池后,经分解池制得纯净的CO2,再在合成塔与H2反应生成甲醇。其工艺艺流程示意图如下:

(1)吸收池中饱和K2CO3溶液吸收CO2的离子方程式是 。
(2)流程示意图中循环使用的物质是 。
(3)300℃时,合成塔中的反应为CO2(g)+3H2(g)  CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)
CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)
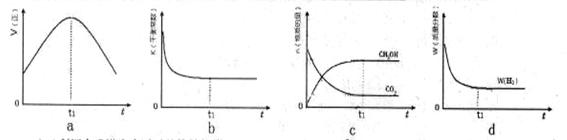
(4)利用合成塔中失活后的铬锌触媒可制得含有Cl- 和CrO42- 的溶液,其浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的AgNO3溶液时,首先产生沉淀的阴离子是 (已知:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12)
(5)合成塔中失活的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:Zn(s) +2MnO2(s) +H2O(l) = Zn(OH)2(s) +Mn2O3(s) ,该电池正极的电极反应式是 。若用电池电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,电解过程中阴极的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市质量检测化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10—10mol2•L—2,Ksp(AgI)=1.0×10—16mo2•L—2。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含浓度均为0.001mol•L—1的Cl—、I—的溶液中缓慢滴AgNO3稀溶液,先析出AgI
C.AgI比AgCl更难溶于水,所以AgCl可转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10—11mol•L—1
×10—11mol•L—1
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10-11
mol·L-1
×10-11
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com