
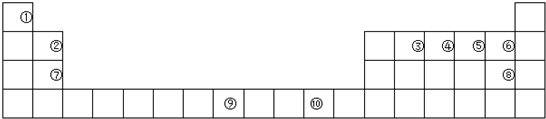
分析 由元素在周期表中的位置可知,①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Fe、⑩为Cu,
(1)为Fe元素,原子核外电子数为26,其外围电子排布式为:3d64s2;
(2)元素③形成的一种不导电单质晶体为金刚石,1个C形成4个C-C,每个键为2个C共用;
(3)元素⑦与①⑤形成的化合物为Mg(OH)2,元素②与⑧形成的物质类似氯化铝;
(4)①与④形成X为NH3,分子空间构型为三角锥形;
(5)HF分子之间形成氢键,缔合形成(HF)n;
(6)Mg与硝酸反应生成硝酸镁、硝酸铵和水.
(7)铜离子水解显酸性.
解答 解:由元素在周期表中的位置可知,①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Cl、⑨为Fe、⑩为Cu,
(1)为Fe元素,原子核外电子数为26,其外围电子排布式为:3d64s2,二价阳离子未成对电子数目为4,故答案为:4;
(2)元素③形成的一种不导电单质晶体为金刚石,为原子晶体,1个C形成4个C-C,每个键为2个C共用,则在该晶体中,元素③的原子个数与形成的共价键键数之比为1:2,故答案为:金刚石;原子晶体; 1:2;
(3)元素⑦与①⑤形成的化合物为Mg(OH)2,含离子键、共价键,元素②与⑧形成的物质类似氯化铝,为共价化合物,
故答案为:离子键、共价键;共价化合物;
(4)①与④形成X为NH3,分子空间构型为三角锥形,用氢键表示式写出X分子间存在的氢键为N-H…N,
故答案为:三角锥形;N-H…N;
(5)HF的相对分子质量实验测得的值一般高于理论值的主要原因是HF分子间通过氢键会形成(HF)n分子(或HF分子间会形成氢键),
故答案为:HF分子间通过氢键会形成(HF)n分子(或HF分子间会形成氢键);
(6)Mg与硝酸反应生成硝酸镁、硝酸铵和水,反应为4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O;
(7)元素⑩的蓝色硫酸盐溶液显酸性,用离子方程式表示其原因为Cu2++2H2O?Cu(OH)2+2H+,故答案为:酸;Cu2++2H2O?Cu(OH)2+2H+.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意物质结构与性质的关系,(5)为解答的难点,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 醇都能发生取代反应,也都能发生消去和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 单质硅能制造光导纤维并在通信领域应用 | |
| C. | 反应:Si+2NaOH+H2O═Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 | |
| D. | 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定是CO32- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 向AlCl3溶液中加入氨水产生白色沉淀,继续滴加至过量沉淀溶解 | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 过滤时,引流的玻璃棒下端触在三层滤纸处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 用pH试纸测溶液的酸性时,应先将试纸用蒸馏水润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸慢慢注入盛有水的烧杯,并不断用玻璃棒搅拌 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将铜丝用盐酸洗涤后,蘸取NaCl溶液,在酒精灯上灼烧观察焰色为黄色证明含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
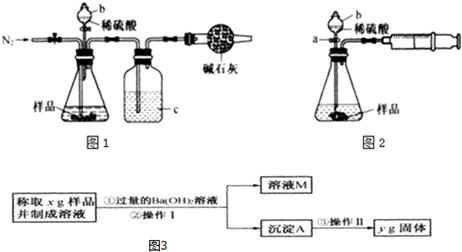
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔沸点依次升高 | |
| B. | 乙醇分子与水分子之间只存在范德华力 | |
| C. | 甲醇的熔点、沸点大于甲烷是由于甲醇分子之间存在氢键 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com