
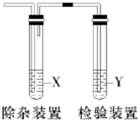
 用如图所示装置检验生成气体时,不能达到目的是( )
用如图所示装置检验生成气体时,不能达到目的是( )| 选项 | 生成的气体 | 试剂X | 试剂Y |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | 溴水 |
| B | 木炭与浓H2SO4加热得到的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH醇溶液共热得 到的乙烯 | 水 | KMnO4 酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | 溴水 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.生成的乙炔气体含有硫化氢,可用硫酸铜溶液除去,然后用溴水检验乙炔;
B.碳与浓硫酸反应生成二氧化碳和二氧化硫,二氧化硫与碳酸氢钠反应生成二氧化碳,干扰了检验结果;
C.醇易挥发,挥发出的醇能够使酸性高锰酸钾溶液褪色,需要先用水除去醇;
D.生成的乙烯中含有二氧化硫,可用氢氧化钠溶液除去,再用溴水检验.
解答 解:A.电石与水反应制取的乙炔中混有硫化氢,需要先用CuSO4溶液除去杂质硫化氢,然后用溴水检验,能够达到实验目的,故A不选;
B.木炭与浓H2SO4加热得到二氧化碳,同时会生成二氧化硫,二氧化硫与NaHCO3溶液反应生成二氧化碳,干扰了检验,无法达到实验目的,故B选;
C.CH3CH2Br与NaOH醇溶液共热得到的乙烯中混有醇,醇能够使酸性高锰酸钾溶液,干扰了检验结果,挥发出的醇可用水吸收,题中试剂能够达到实验目的,故C不选;
D.C2H5OH与浓H2SO4加热至170℃制取的乙烯中混有二氧化硫,二氧化硫能够使溴水褪色,需要先用NaOH溶液除去杂质二氧化硫,然后再用溴水检验乙烯,能够达到实验目的,故D不选;
故选B.
点评 本题考查化学实验方案的评价,题目难度中等,涉及常见气体检验、醇、卤代烃及浓硫酸的性质,明确常见有机物组成、结构与性质为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
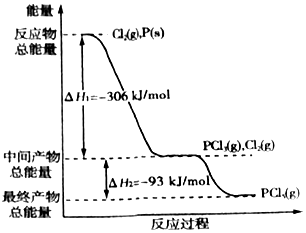 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 吸热反应在需要在加热条件下才能发生 | |
| D. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
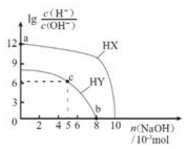 溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
溶液的酸碱性可用酸度(AG)表示[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$],室温下,向浓度均为0.1mol/L体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX、HY均为弱酸 | |
| B. | a点由水电离出的c(H+)=1.0×l0-13mol•L-l | |
| C. | c点溶液中:c(Y-)<c(Na+)<c(HY) | |
| D. | b点时,溶液的pH=7,酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
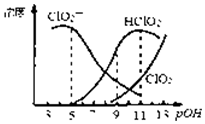 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用.已知POH=-lgc(OH-),经测定25℃时各组分含量随POH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | PH=7时,溶液中含氯微粒的浓度大小:c(ClO2-)>c(HClO2)>c (ClO2) | |
| C. | HClO2的电离平衡常数的数值Ka=10-6 | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有2c(HClO2)+c(H+)=2c(ClO2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
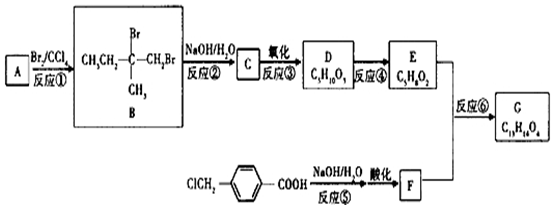
 ;F含有的官能团名称是羧基、羟基.
;F含有的官能团名称是羧基、羟基. .
.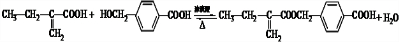 或
或 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com