
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
分析 (1)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1②
将方程式 $\frac{①+②}{2}$得甲烷直接将NO2还原为N2的热化学方程式;
(2)依据亚硝酸根离子水解平衡常数表达式变式计算分析;
(3)正反应放热,则升高温度CO的转化率降低;
(4)对比I、Ⅱ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动;
根据I中数据计算平衡常数,计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(5)原电池中阳离子移向正极,负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O;
解答 解:(1)CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1②
将方程式$\frac{①+②}{2}$CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=$\frac{-574-1160}{2}$kJ/mol=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1;
(2)NO2-+H2O?HNO2+OH-,Kh=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$,则Kw=Kh×Ka=8.0×10-10mol•L-1×9.7×10-4mol•L-1=7.76×10-13,>常温下Kw=10-14,温度高于常温,>25°C,
故答案为:Ka×Kh,>;
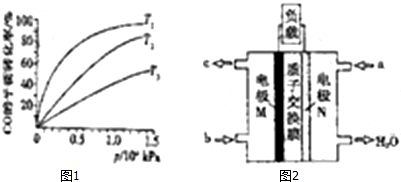
(3)根据该反应为放热反应,温度越高CO的转化率越小,图中T1、T2、T3的高低顺序T1<T2<T3,
故答案为:T1<T2<T3,该反应为放热,温度越高,反应物的转化率越低;
(4)对比I、Ⅱ可知,升高温度CH3OCH3(g)的物质的量减小,说明平衡逆向移动,而升高温度平衡向吸热反应移动,则正反应为放热反应,容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=$\frac{0.08mol}{1L}$=0.080mol/L,c(CH3OH)$\frac{0.2mol-0.08mol×2}{1L}$=0.04mol/L,容器Ⅰ中化学平衡常数K1=$\frac{0.08×0.08}{0.0{4}^{2}}$=4,此时浓度商Qc=$\frac{0.15×0.1}{0.1{5}^{2}}$=0.67<K=4,反应向正反应进行,
故答案为:放热,正;
(5)图分析可知a端电极N为正极,质子穿过交换膜移向N电极,M电极为负极,负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故答案为:N,CH3OH+H2O-6e-=CO2+6H+;
点评 本题目综合考查盖斯定律的应用、化学反应平衡常数的计算和应用、图象分析判断等方面的知识,侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键,题目难度中等.注意料电池反应的特点.


科目:高中化学 来源: 题型:选择题
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
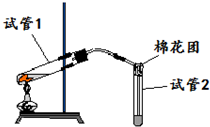 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
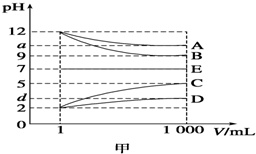 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4 | B. | 1:2 | C. | 1:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
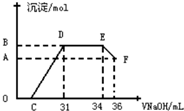 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com