
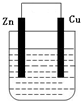
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。

(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+ 移向 极,铜极上的电极反应式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是 , 若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g。
(1)锌(1分); 铜(1分) ; 2H++2e-= H2↑(1分);
(2)Cu2+ +2e- = Cu(1分); 0.1 (1分)
【解析】在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极。
(1)如果是稀硫酸,则发生氧化反应的是锌,氢离子向正极移动,即向铜电极移动,方程式为2H++2e-= H2↑。
(2)如果是硫酸铜,则正极是铜离子得到电子,方程式为Cu2+ +2e- = Cu。根据电极反应式可知,转移0.2mol电子,生成0.1mol铜,消耗0.1mol锌,所以溶液质量增加是6.5g-6.4g=0.1g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置.
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置.查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市高一下学期期末考试化学试卷(带解析) 题型:实验题
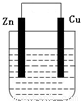
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+ 移向 极,铜极上的电极反应式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是 ,若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市高一(下)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com