
| 10-6+10-4 |
| 2 |
| 10-4 |
| 2 |
| Kw |
| c(OH-) |
| 1.0×10-14 | ||
|


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:
Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加)。
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
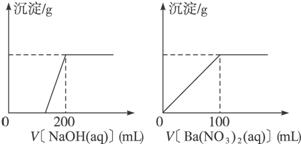
(1)请通过计算确定m的值;
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.实验表明,CuO被H2还原时也有Cu2O生成。将一定量的H2缓慢通过灼热的CuO粉末,得到固体混合物且混合物中m(Cu)∶m(O)=8∶a。当a有不同的取值时,固体混合物成分不同。请分析a的取值范围和固体混合物成分的关系并填入下表(不一定填满,表格不够也可自行增加):
a的取值范围 | 反应后固体的成分(用化学式表示) |
|
|
|
|
|
|
Ⅱ.黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05 mol·L-1的NaOH溶液,向另一份溶液中滴加0.600 mol·L-1 Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
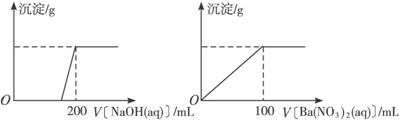
(1)请通过计算确定m值。
(2)X的摩尔质量为368 g·mol-1,请确定X的化学式。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高二下学期期中考试化学试题 题型:填空题
(8分)水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为 。(原子量Ca:40,O:16,H:1)
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)水的电离平衡曲线如图所示。
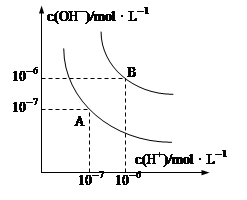
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为 。(原子量Ca:40,O:16,H:1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com