
| A. | 增加Fe的物质的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入水蒸气 | |
| D. | 压强不变,充入Ne使容器的体积增大 |
分析 对于反应3Fe(s)+4H2O(g)?Fe3O4+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:A.Fe为固体,增加铁的量,反应速率不变,故A选;
B.将容器的体积缩小一半,气体浓度增大,反应速率增大,故B不选;
C.保持体积不变,充入水蒸气使体系压强增大,反应物浓度增大,反应速率增大,故C不选;
D.压强不变,充入Ne使容器的体积增大,反应气体的浓度减小,反应速率减小,故D不选.
故选A.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为D,注意压强与浓度的关系.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cu与含2 mol H2SO4的浓硫酸加热反应,转移的电子数为 2 NA | |
| B. | 5.80g[2 CaSO4.H2O]中含有的H2O分子数为0.04NA(M(2 CaSO4.H2O)=290g.nol-1) | |
| C. | 0.1 mol BaO2与足量的CO2完全反应转移电子数目为0.1NA | |
| D. | 10 mL 5 mol•L-1(NH4)2CO3溶液中含有N原子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.| A. | 加强海底可燃冰的探测与开发研究 | |
| B. | 积极推广风能、水能和太阳能发电 | |
| C. | 在生产、流通、消费等领域中实行“减量化、再利用、资源化” | |
| D. | 将高能耗、高污染的企业迁至偏僻的农村地区,提高农民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
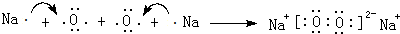 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中阴阳离子的个数比都是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
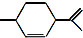 下列关于它的说法不正确的是( )
下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 常温下呈液态,难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com