
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
【答案】C
【解析】
A.pH=4.2时,c(H+)=10-4.2mol·L-1,c(HA-)=c(A2-),K2(H2A)=c(A2-)·c(H+)/c(HA-)=10-4.2;pH=1.2时c(H2A)=c(HA-),则Kh(HA-)=c(OH-)·c(H2A)/c(HA-)=c(OH-)=10-12.8<10-4.2,说明HA-的水解能力小于HA-的电离能力,故A正确;
B.pH=4.2时,c(H+)=10-4.2mol·L-1,c(HA-)=c(A2-),K2(H2A)=c(A2-)·c(H+)/c(HA-)=10-4.2,则lg[K2(H2A)]=-4.2,故B正确;
C.将等物质的量的NaHA和Na2A混合物溶于水,由于NaHA的电离程度和Na2A的水解程度不同,所得的溶液中α(HA-)与α(A2-)不相等,故C错误;
D.根据0.1 mol·L-1 NaHA溶液中的物料守恒可知:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2 mol·L-1,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
(1)X元素在周期表中的位置是____;W2+离子的外围电子排布式为___。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为___、___,该化合物分子中的π键与σ键的个数之比是____;该物质易溶于水的主要原因是___。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be元素两者相应的最高价氧化物对应水化物相互反应的化学方程式:____。
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子的配位数是___。某M配合物的化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是____。

(5)Y离子和Z离子比较,半径较大的是___(填离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最近的Y离子有___个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列气体:H2、Cl2、CH4、HCl、NH3、NO、H2S、SO2,用如图装置进行实验,填写下列空白:

(1)当烧瓶干燥时,从A口进气可收集的气体是___________,从B口进气可收集的气体是___________。
(2)当烧瓶中充满水时,可用来测___________等气体的体积。
(3)可用启普发生器制取的气体有___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )
![]() 和
和![]() 都有顺反异构
都有顺反异构
②有机化合物分子中饱和碳原子上连接四个不同的原子或原子团时,可能存在光学异构
![]() 碳原子数不同的直链烷烃一定是同系物
碳原子数不同的直链烷烃一定是同系物
④正戊烷、异戊烷、新戊烷的沸点依次降低
⑤能够快速、微量、精确的地测定相对分子质量的物理方法是核磁共振氢谱法
A. ①③⑤ B. ②③④C. ②③⑤ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法不正确的是( )
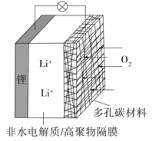
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向锂电极迁移
D.充电时,电池总反应为Li2O2-x=2Li+ (1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如图所示,下列说法正确的是

A. 1mol该有机物最多可以和5mol NaOH反应
B. 该有机物容易发生加成、取代、中和、消去等反应
C. 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D. 1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员最近发明了一种水电池,这种电池能利用淡水和海水之间的含盐量差进行供电,该电池的化学反应为:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl
(1)简述Na2O熔点比NaCl高的其原因。_______________________
(2)将Al粉和MnO2混合,经高温引发反生反应,写出化学反应方程式。__________________________,若反应中生成5.5kg单质,则转移电子的数目是________个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X的化学式可能是________________、________________。
(4)将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,请写出离子方程式。______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com