
| A. | ②③④⑤⑥ | B. | ②③④ | C. | ②⑤⑥ | D. | ①③⑤ |
分析 常见的放热反应有:所有的物质燃烧;所有金属与酸或与水;所有中和反应;绝大多数化合反应;铝热反应;
常见的吸热反应有:绝大数分解反应;个别的化合反应(如C和CO2);工业制水煤气;碳、一氧化碳、氢气还原金属氧化物;某些复分解(如铵盐和强碱).
解答 解:①水蒸气变成液态水是物理变化,故①错误;
②酸碱中和反应是放热反应,故②正确;
③浓硫酸稀释是物理变化,故③错误;
④NaOH固体溶于水主要是两种的扩散属于物理变化,故④错误;
⑤H2在Cl2中燃烧是发生的放热反应,故⑤正确;
⑥食物腐败是缓慢氧化是放热反应,故⑥正确.
故选C.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题

| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
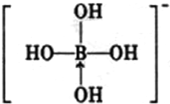 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢都是合金 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 溶液中所有离子的浓度都减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mLpH=11的NaOH溶液,混合液的pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com