
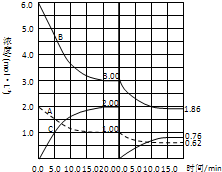
 在恒容条件下发生反应A(g)+3B(g)
在恒容条件下发生反应A(g)+3B(g)| 催化剂 |
| A、第Ⅰ阶段用C表示的平衡前的反应速率v (C)=0.1 mol/(L?S) |
| B、第Ⅱ阶段中B的平衡转化率αⅡ(B)为0.019 |
| C、第Ⅰ阶段的平衡常数KⅠ与第Ⅱ阶段平衡常数KⅡ的大小关系是:KⅠ<KⅡ |
| D、由第一次平衡到第二次平衡,可能采取的措施是从反应体系中移出产物C |
| △c |
| △t |
| 2mol/L |
| 20min |
| 1.14mol/L |
| 3mol/L |


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(2013?青岛一模)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(min) 浓度(mol/L) |
0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
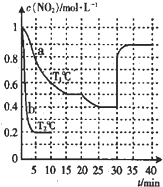 (2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.
(2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
在温度,容积相同的3个密闭容器中,按不同方式投入反应物,在保持恒温、恒容条件下发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,测得相关数据如下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
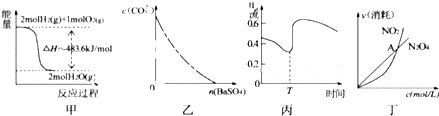
| A、图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ?mol-1 | B、图乙表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 | C、图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 | D、图丁表示恒温恒容条件下发生的可逆反应2NO2?N202(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com