
 H2O的结构式H-O-H.
H2O的结构式H-O-H. 分析 (1)氯气与石灰乳反应生成氯化钙、次氯酸钙和水;
(2)漂白粉与水、二氧化碳反应生成碳酸钙、HClO;
(3)非金属元素之间形成共价键,只含共价键的化合物为共价化合物,金属与非金属之间形成离子键,含离子键的为离子化合物,含共价键、离子键的为离子化合物;
(4)氯化钙只含离子键,水中只含共价键.
解答 解:(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(2)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(3)以上涉及的物质中,属于共价化合物的有CO2、H2O(或HClO),属于离子化合物的有CaCl2、Ca(OH)2[或CaCO3、Ca(ClO)2],既有离子键又有共价键的物质有Ca(OH)2[或Ca(ClO)2],
故答案为:CO2、H2O; CaCl2、Ca(OH)2;Ca(OH)2;
(4)CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为
,水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,其结构式为H-O-H,为V型结构,
,其结构式为H-O-H,为V型结构,
故答案为: ;H-O-H.
;H-O-H.
点评 本题考查含氯化合物的性质,为高频考点,把握物质的性质、发生的反应、化学键的判断为解答的关键,侧重分析与应用能力的考查,注意漂白粉在生活中的应用,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:推断题
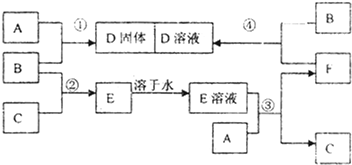
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是无机化合物,天然气和石油是有机化合物 | |
| B. | 利用化石燃料燃烧放出的热量使分解产生氢气,是氢能开发的研究方向 | |
| C. | 化学电源放电、植物光合作用都能发生化学变化,但没有能量的转化 | |
| D. | 若化学过程中断开化学键吸收的能量大于形成化学键所放出的能量,则反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
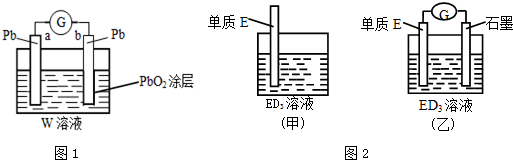
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、MnO4-、K+、NO3- | B. | Na+、Mg2+、SO42-、Cl- | ||
| C. | Na+、Ba2+、OH-、NO3- | D. | K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ②>①>③>④>⑤ | C. | ②>③>④>①>⑤ | D. | ⑤>④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Zn | C. | Fe | D. | Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Cu+8HNO3═3Cu(NO3)2+2NO↑十4H2O | B. | C+4HNO3═CO2↑+4NO2↑十2H2O | ||
| C. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | D. | NaOH+HNO3═Na NO3十H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com