
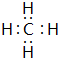 ;
;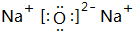 ;
;分析 A、B、C、D、E五种元素,元素A的一种原子无中子,则A为氢元素;元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,则B为碳元素、C为O元素;元素D有三个电子层,它和元素C属于同一主族,则D为硫元素,硫和氧可以生成有刺激性气味的气体SO2;元素E的阳离子E+的电子层结构与Ne的电子层结构相同,则E为Na元素.
解答 解:A、B、C、D、E五种元素,元素A的一种原子无中子,则A为氢元素;元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,则B为碳元素、C为O元素;元素D有三个电子层,它和元素C属于同一主族,则D为硫元素,硫和氧可以生成有刺激性气味的气体SO2;元素E的阳离子E+的电子层结构与Ne的电子层结构相同,则E为Na元素.
(1)由上述分析可知,A为氢,B为碳,C为氧,D为硫,E为钠,
故答案为:氢;碳;氧;硫;钠;
(2)H与C可以形成CH4、HC≡CH等,以共价键相结合,CH4的电子式为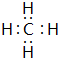 ,
,
O和Na可以形成氧化钠,也可以形成过氧化钠等,所以它们形成的化合物以离子键或离子键、共价键结合,Na2O的电子式为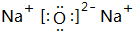 ,
,
故答案为:共价;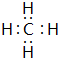 ;离子(或离子键、共价键);
;离子(或离子键、共价键);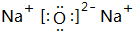 ;
;
(3)同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径Na>S>C>O>H,
故答案为:Na>S>C>O>H;
(4)A和C的化合物为H2O,C和E的化合物为Na2O2,二者反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查结构性质位置关系应用,关键是推断元素,侧重对化学式用语与元素周期律、元素化合物组成与性质的考查,难度不大,有利于基础知识的巩固.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 催化剂是改变化学反应速率最有效的手段之一,使用催化剂可以带来巨大的经济效益 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,太阳能电池可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 有机高分子合成为人类提供了大量的新材料,聚氯乙烯、有机玻璃、腈纶、酚醛树脂等都属于合成高分子材料,都是通过加聚反应得到的 | |
| D. | 计算机技术的发展,使化学研究进入了分子水平,分子设计的思想为合成人类需要的新物质开辟了更广阔的道路 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若A2和B2的总能量大于生成的AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2>Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应类型加聚反应.
;反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭燃烧:C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 | |
| B. | 煅烧石灰石:CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑ | |
| C. | 铁的冶炼:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | 电解水:2H2O$\frac{\underline{\;通电\;}}{\;}$2 H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
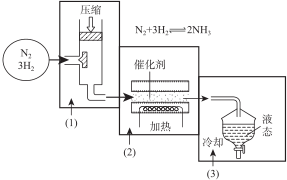
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com